扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

引 言
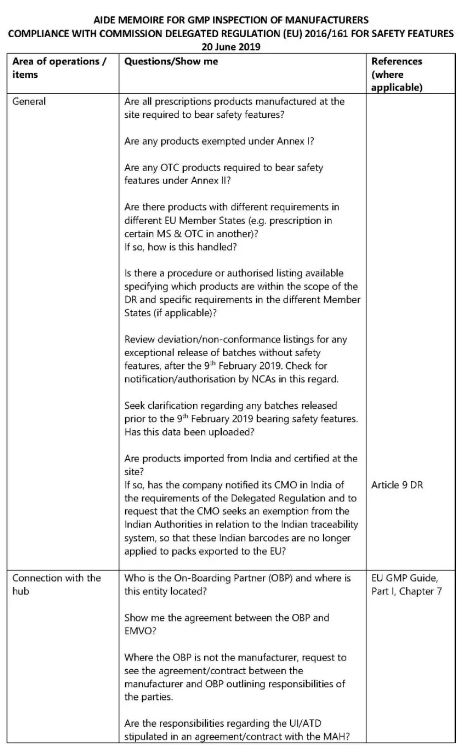
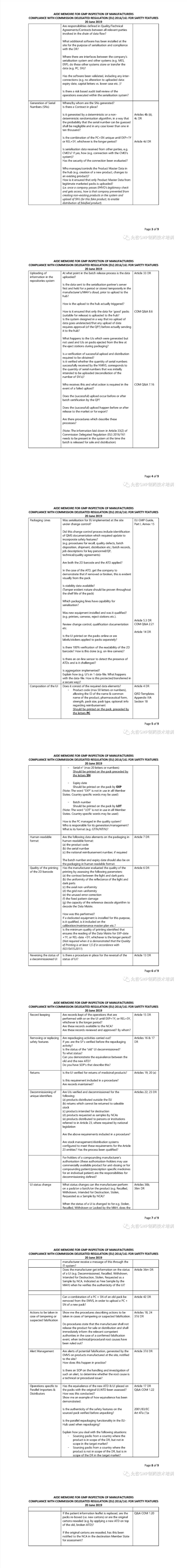
2019年6月20日,欧盟委员会发布了《欧盟法令安全特性的GMP符合性检查备忘录》,首次明确规定了GMP对包装线的序列化追溯及安全特性环节的标准,而不仅仅局限于生产环节。
值得一提的是:此前欧盟和中国GMP均未明确在序列化追溯领域要求企业符合GMP标准。而今,中国新版GMP以欧盟GMP为参考,对企业在无菌制剂和原料药的生产方面提高了标准。因此,欧盟GMP法规所呈现的方向,将成为全球医药企业及追溯行业的大趋势。
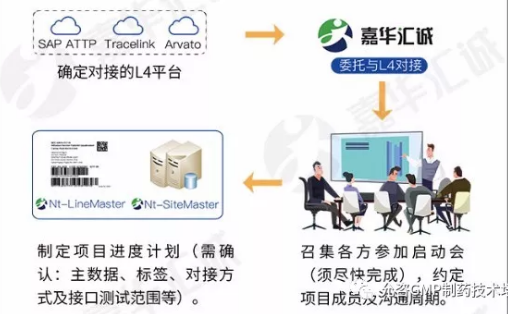
企业亟需实现生产企业GMP合规与序列化追溯法规相结合,为此允咨中心特举办(7月上海)中国及欧美最新发布药品追溯系统法规解读及计算机化系统验证实施 高级研修班,帮助企业实现药品从生产到患者使用全过程可监督追溯。
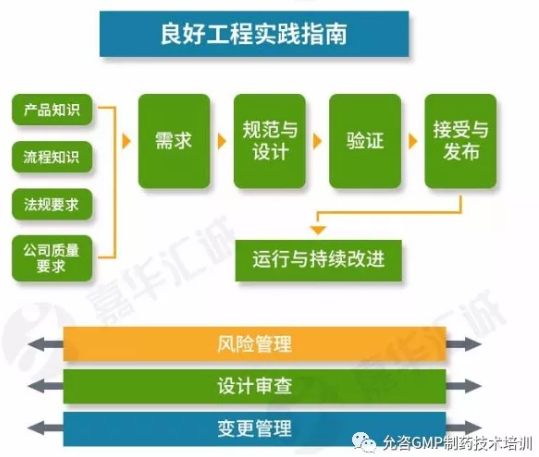
此版备忘录还阐明了18个GMP延伸检查的具体方面,具体如下:
连接EU-HUB(欧盟药品追溯数据分发平台)
注册NMVO(成员国药品验证组织)
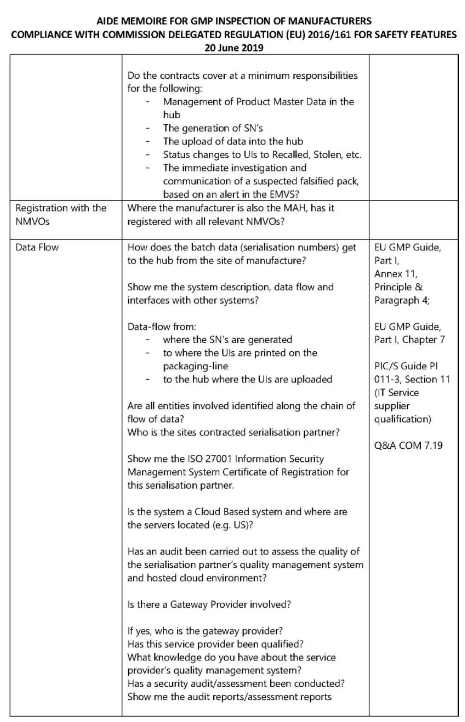
数据流
生成SN(序列号)
上传信息到数据交换系统
包装线
UI(唯一身份标识)的组成
人眼可读格式
二维码的打印质量要求

恢复UI的停用状态
记录管理
移除或更换安全(ATD)特性
(产品)退回
唯一身份标识的停用
唯一身份标识状态变革
怀疑合法性时时应采取的措施
警报管理
平行进口商和分销商特有的操作
备忘录原文
延伸阅读
此前,欧盟委员会于2011年7月颁布了 “EU-FMD欧盟反假药法案”,且于2019年2月9日正式生效。同时,EMVO管理的EU-HUB也已正式上线运行。此法案强制要求的安全特性包括:包装序列化要求、药盒防篡改安全装置、药品数据上传和验证要求。
文章来源:允咨GMP制药技术培训
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。