扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

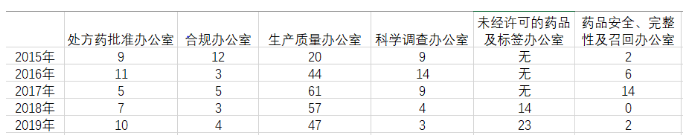
FDA警告信,FDA Warning Letter,备受业界的关注。通过学习这些警告信,新药研发企业可以汲取他人之经验教训,不断完善提高。据FDA官网显示,2019年FDA发布警告信89封;2018年发布85封;2017年发布94封;2016年发布78封;2015年发布52封。下表为各办公室发布的警告信的统计:
以下为FDA警告信的查阅地址。
1、Warning Letter 2015
https://www.fda.gov/drugs/warning-letters-and-notice-violation-letters-pharmaceutical-companies/warning-letters-20152、Warning Letter 2016https://www.fda.gov/drugs/warning-letters-and-notice-violation-letters-pharmaceutical-companies/warning-letters-20163、Warning Letter 2017https://www.fda.gov/drugs/warning-letters-and-notice-violation-letters-pharmaceutical-companies/warning-letters-20174、Warning Letter 2018https://www.fda.gov/drugs/warning-letters-and-notice-violation-letters-pharmaceutical-companies/warning-letters-20185、Warning Letter 2019https://www.fda.gov/drugs/warning-letters-and-notice-violation-letters-pharmaceutical-companies/warning-letters-2019
其中,数据可靠性问题受到FDA和业界越来越大的关注。这些问题大多分为技术硬件问题和人员培训、管理问题。很多制药企业都引入了可审计追踪的系统,虽然这些系统能从硬件上帮助药企完善数据可靠性,但这些远远不够。作为制药行业的一员,仅从制药人的角度考虑数据可靠性方面的问题是远远不够的,我们还需要从监管机构的角度来看待公司在数据可靠性方面是否存在漏洞或者监管不到位的地方。2019年8月20日,美国FDA官网发布新闻稿,题目是“FDA warns company for putting consumers at risk with drug manufacturing data integrity violations”,警告数据可靠性方面的违规企业。之前,FDA发布了很多关于数据可靠性的警告信和新闻稿。本新闻稿的特别之处在于:这很有可能是历史上第一次FDA局长就数据可靠性的违规行为发表评论。

文章来源:蒲公英
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。