扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

一、法规要求
二、分析方法验证
三、分析方法确认
四、分析方法验证和确认总结
一、法规要求:新版GMP(2010年修订)
第二百二十三条 物料和不同生产阶段产品的检验应当至少符合以下要求:
(一)企业应当确保药品按照注册批准的方法进行全项检验。
(二)符合下列情形之一的,应当对检验方法进行验证。
1. 采用新的检验方法;
2. 检验方法需变更的;
3. 采用《中华人民共和国药典》及其他法定标准未收载的检验方法;
4. 法规规定的其他需要验证的检验方法。
(三)对不需要进行验证的检验方法,企业应当对检验方法进行确认,以确保检验数据准确、可靠。
法规要求:中国药典(2010年 版)凡例
1. 检验方法和限度。
2. 二十三、本版药典正文收载的所有品种,均应按规定的方法进行检验。如采用其他方法,应将该方法与规定的方法做比较试验,根据试验结果掌握使用,但在仲裁时仍以本版药典规定的方法为准。
法规要求:分析方法确认或验证相关指南

二、分析方法验证
1. 分析方法验证的定义
2. 分析方法验证的目的
3. 分析方法验证范围
4. 分析方法验证的时机
5. 需验证的分析方法类型
6. 分析方法验证的具体内容
7. 验证检测项目小结
8. 分析方法验证的方式和步骤
9. 分析方法验证常见问题
1. 分析方法验证的定义
是根据检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。
2. 分析方法验证的目的
(1)证明采用的分析方法是科学、合理。
(2)证明分析方法能有效控制药品的内在质量。
♦ 验证过程和结果均应记载在标准起草或修订说明中。
3. 分析方法验证范围
(1)适用范围:化学药品的理化分析方法和仪器分析方法的验证与确认;清洁验证方法的验证。
(2)不适用:化学药品的微生物方法;生物制品分析方法验证。
4. 分析方法验证的时机
(1)建立新的药品质量标准;
(2)药品生产工艺变更;
(3)制剂的组分变更;
(4)对原分析方法进行修订时。
方法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。
5. 需验证的分析方法类型
(1)鉴别试验
(2)杂质定量或限度检查(仪器或非仪器检测方法)
(3)原料药或制剂中活性成分以及制剂中选定组分(如防腐剂等)的定量测定含量测定
(4)化学药品/中药制剂中其他需控制成分(如残留物、添加剂等)的测定
(5)制剂溶出度、释放度等检查
(6)原料药粒度检测
6. 分析方法验证的具体内容
(1)专属性
(2)线性
(3)范围
(4)准确性
(5)精密度
(6)检测限
(7)定量限
(8)耐用性
(9)系统适用性
根据检测的类型,采用的技术检测方法,确定具体方法拟订验证的内容。
专属性
1. 鉴别、杂质和含量测定的方法学验证中应进行专属性研究,证明专属性所采用的方法取决于分析方法的预定检测对象。
2. 一种分析方法不太可能对某一特定的被分析物具有专属性(完全辨别),在此情况下,建议采用两种或两种以上的分析方法以达到所需的辨别水平。
鉴别:合适的鉴别实验应能区别出可能存在结构相似的化合物。可以通过与已知参比物比较,从含有被分析物的样品中得到的正结果和不含被分析物的样品中得到的负结果来确定。此外,也可以采用与被测物结构相似或相关的物质进行鉴别实验。对于这些可能会有潜在干扰的物质的选择应当基于对这些干扰的物质做出合理的科学评判。
含量测定和杂质检测:对于色谱方法来说,应当用具有代表性的色谱图来证明专属性,并在图上适当地标出每一种成分,其他分离技术也应当有相似的考虑。应当在适合的程度上研究关键的色谱分离度。对于关键的分离度,能够通过两个洗脱最靠近的化合物之间的分辨率来证明方法的专属性。
当用非专属性方法做含量测定时,应当采用其他辅助性的分析方法来证明整体的专属性,例如:当为了放行而采用滴定法测定原料药含量时,可以合并采用这种含量测定方法以及一种适当的杂质检查方法。
常用的试验方法:
空白阴性对照试验
比较同一分析系统对照品与供试品相应色谱峰的吸收光谱:
色谱-质谱联用验证待测成分
线性
线性系指在设计的范围内,测试结果与供试品中被测物浓度直接呈正比关系的程度。
试验方法:
(1)制备至少包含5个浓度(梯度浓度)的对照品溶液,分别进样测定
(2)以测得的响应信号作为被测物浓度的函数作图,观察是否呈线性
(3)最小二乘法进行线性回归
数据要求:
应列出回归方程、相关系数和线性图。
范围
范围系指能达到一定精密度、准确度和线性,测试方法适用的高低限浓度或量的区间。
确认方法是通过把含有被测物的样品在范围的两个极端和范围内进行测试,考察是否可达到精密度、准确度的线性的要求。
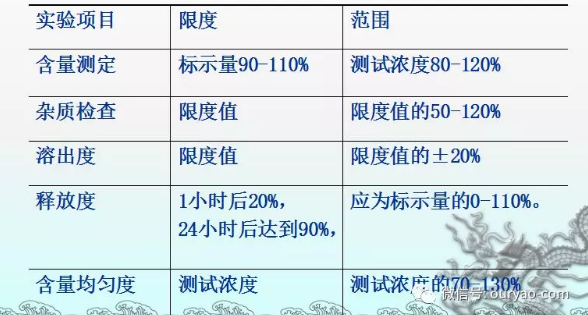
范围(中药和复方制剂)
含量限度有上下限的,一般设定范围低限为含量限度下限的50~70%,范围的高限为含量限度上限的130~150%。含量限度仅有低限的,一般设定范围为含量限度的50%~70%至含量限度的2~5倍以上。以标示量规定含量限度的,可参照化学药, 一般设定范围为标示量的80%~120%。
含量限度应根据中药制剂实测结果与原料药材的含量情况确定。尽可能多的测定数据才有足够的代表性,至少应有10批以上样品与原料药材数据为依据,一般原粉入药的转移率要求在90%以上。有毒成分及中西药复方制剂中化学药品的含量应规定上下限,上下限幅度应根据测试方法、品种情况、转移率及理论值确定,一般应在±5%~±20%之间,并在安全有效范围内,制定上下限应有充分依据。
准确度
系指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(%)表示。
a. 以经典方法的测定值作为真值,建立方法的测定数据与之比较。(该法适用于化学药品)
b. 以加入对照品测定的回收率表示,一般有空白回收(制剂空白)和加样回收测定的方法。(中药材、复方制剂等)

准确度 —原料药
(1)用已知纯度的被分析物(如参比物质)进行测定。
(2)用提出的分析方法的检测结果与第二种成熟的分析方法的检测结果做比较,而后者的准确性是有规定的和(或)经确定的。
(3)准确性可以在精密度、线性和专属性建立后,推论而得。
准确度 —制剂
(1)用该分析方法测定药物制剂成分与添加的已知量被分析原料药的混合物?
(2)如在不能获得制剂所有成分的样品时,可以将已知量的被分析物加入到制剂中,或者将测得的结果与另一种已鉴定分析方法的分析结果进行比较,而后者的准确性是有规定的和(或)经确定的。
(3)在精密度、线性和专属性建立后,可以推断准确性。
准确度-杂质的定量测定
(1)应当通过用已知量杂质加强样品(原料药/制剂)检测信号的方式来评价准确性。
(2) 在不能获得特定杂质和(或)降解产物样品的情况下,可以考虑与另一种成熟的方法所测得的结果做比较。可以使用原料药的响应因子。如药典方法或经过验证的方法。
(3)应当明确如何确定每个单一杂质或总杂质:如:所有成分相对于主摹被分析物的重量/重量首分比或峰面积百分比。
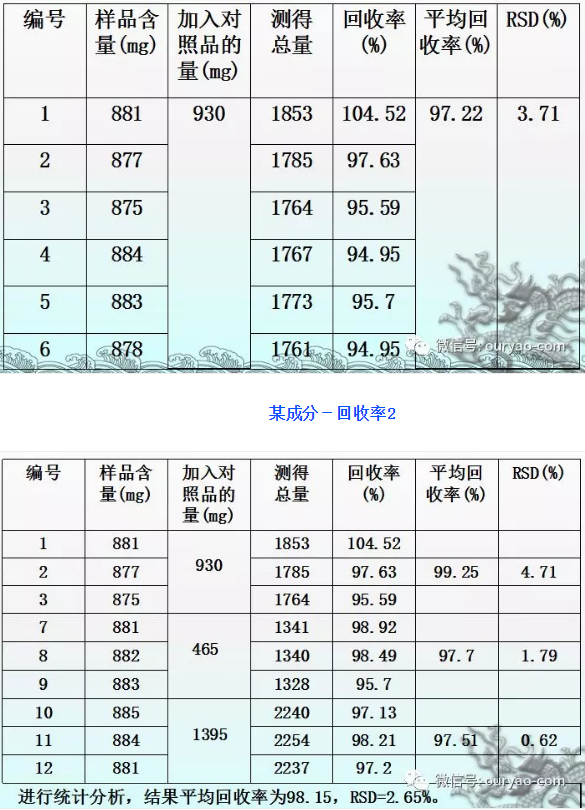
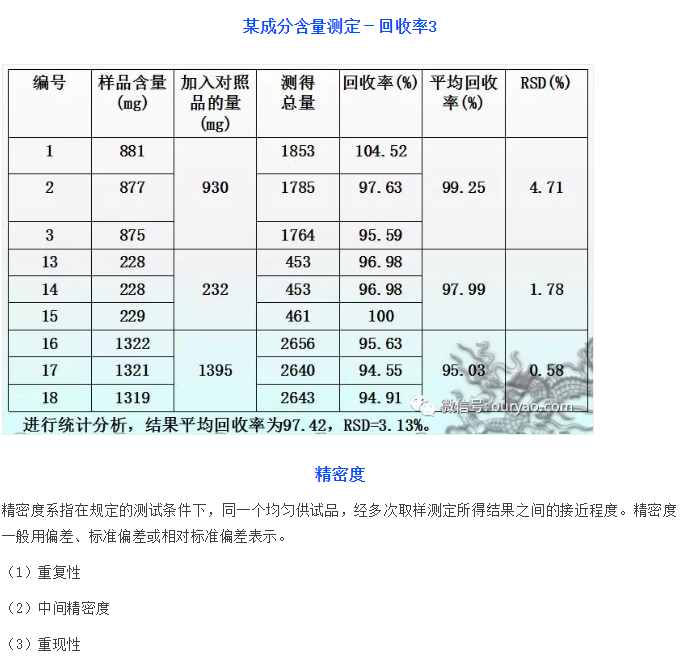
某成分含量测定-回收率1
文章来源:药研技术汇
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。