扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

日前,MorphoSys和Incyte联合宣布,美国FDA已加速批准Monjuvi(tafasitamab-cxix)上市,与来那度胺(lenalidomide)联用,二线治疗成人复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者,包括低级别淋巴瘤引起的DLBCL,以及不适合接受自体干细胞移植(ASCT)的患者。Monjuvi是一种通过改造抗体Fc端增强细胞介导的细胞毒性反应的人源化抗CD19单克隆抗体,这一批准是根据总缓解率(ORR)获得的加速批准。
DLBCL是全球成人中最常见的非霍奇金淋巴瘤类型,以淋巴结、脾脏、肝脏、骨髓或其他器官中快速生长的恶性B细胞肿瘤为特征。它是一种侵袭性疾病,约三分之一的患者对初始治疗无响应或随后复发。在美国,每年约有1万例患者被诊断为不适合接受ASCT的复发/难治性DLBCL。

2010年,MorphoSys从Xencor获得了开发tafasitamab的全球独家权益。Tafasitamab利用了名为XmAb的Fc结构域改造技术,通过改造抗体的Fc端,能够将抗体与Fcγ受体的亲和力提高40倍,从而更好地激活先天杀伤细胞(NK cells)、巨噬细胞等免疫细胞,通过抗体依赖性细胞介导的细胞毒性(ADCC),和抗体依赖性细胞吞噬作用(ADCP)介导B细胞裂解。FDA此前授予Monjuvi和来那度胺联合治疗复发/难治性DLBCL的快速通道和突破性疗法认定和优先审评资格。
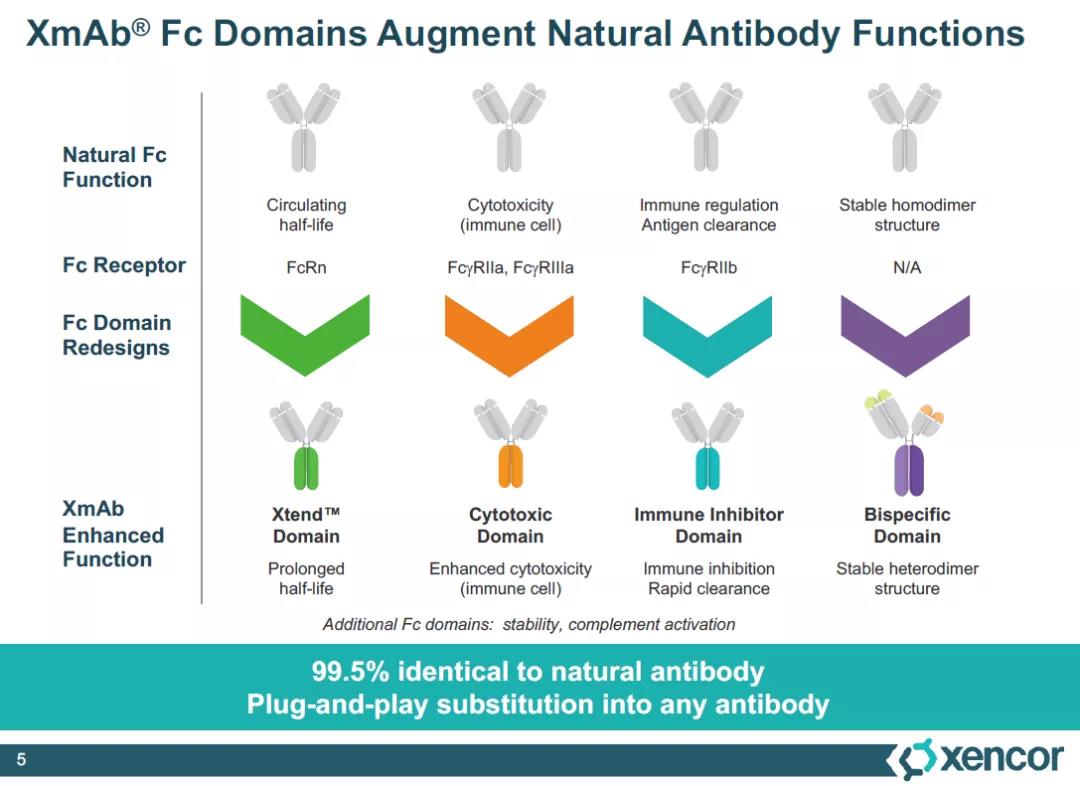
▲XmAb技术平台能够通过改造Fc结构域增强抗体的多种特征(图片来源:Xencor官网)
FDA的批准是基于MorphoSys进行的开放标签,多中心、单组2期临床试验L-MIND的数据。研究结果显示,Monjuvi与来那度胺联用,达到55%的总缓解率(ORR),包括37%的完全缓解率和18%的部分缓解率。中位缓解持续时间(mDOR)为21.7个月。
MorphoSys公司首席执行官Jean-Paul Kress博士说:“我们非常高兴FDA批准了Monjuvi联合来那度胺作为二线治疗复发/难治性DLBCL患者的首个药物,我们感谢所有参与Monjuvi试验的卫生保健专业人员、患者和他们的家人。”
“FDA批准Monjuvi联合来那度胺有助于解决复发/难治性DLBCL患者的迫切的未满足医疗需求,”Incyte公司首席执行官Herve Hoppenot先生说:“在Incyte,我们致力于将这一急需的新型靶向治疗选择带给合适的患者。”
参考资料:
[1] FDA Approves Monjuvi® (tafasitamab-cxix) in Combination With Lenalidomide for the Treatment of Adult Patients With Relapsed or Refractory Diffuse Large B-cell Lymphoma (DLBCL). Retrieved 2020-08-01, from https://www.businesswire.com/news/home/20200731005497/en/FDA-Approves-Monjuvi®-tafasitamab-cxix-Combination-Lenalidomide-Treatment
文章来源:药明康德
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。