扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

介绍
良好文件管理规范的目的是建立清晰简明的规范性文件,并且能供业内相关人员无障碍的阅读。良好文件管理规范涵盖了数据完整性。
范围和目的
GEP文件指的是调试期间的工程记录,GMP记录指的是确认期间的记录。下表对GEP和GMP程序中测试和文件标准之间差异进行了详细对比。
|
调试 |
确认 |
|
需进行反复调试,最终的测试记录需要永久保存。(例如,空调净化系统的平衡测试) |
须严格执行方案,过程事件需要准确记录,所有偏差/异常情况以及再测试都需要有书面的证明文件。 |
|
应遵循工程测试规范(例如ISO [18], NEBB [28]),涵盖测试计划。在批准的规范中需要有可接受标准。 |
需要有测试项的指导性规程,并包含预定的可接受标准。 |
|
工程验收主要用于确认非关键方面(例如,注射用水分配系统的管道压力)的技术参数和设计。 |
质量部门评估并批准用来确认系统适合预期目标的可接受标准,包括关键方面/关键设计因素的确认。 |
|
普遍适用良好文件管理规范。 |
GMP记录中需要有企业/当地的规范,例如验证文件。 |
|
其严格程度应通过风险评估(设备的功能方面)来确定。 |
其严格程度应通过风险评估(GMP符合性)来确定。 注:在系统的调试与确认阶段应无产品风险存在。 |
两类文件批准程序的要求差异:
确认的测试策略和可接受标准由质量部门批准。按照批准的测试策略制定出的确认测试和确认文件,可经质量部门的批准,也可不经质量部门的批准。
调试文件通常不需质量部门批准。测试策略和可接受标准一般需工程部门的批准。
供应商确认文件的要求:当决定使用供应商的文件来作为系统关键方面/关键设计因素的确认文件时,其理由需形成文件并经专业负责人和质量部门的批准。
C&Q文件开发基础
鼓励使用表格/模板来促进一致性。如果相关内容没有更改,可以在创建表格/模板时批准一次,然后在没有预先批准的情况下多次使用。在采用这种方法时,应该有一个流程来确保用于数据输入的表单/模板在使用时是现行版。
当使用表格/模板时,专业负责人应审核表格,以确保该表格包括该系统验证所需的所有测试项目,如需增加额外的测试,该表格/模板应补充额外的测试内容。测试原稿可以分开审批,并合并成测试计划/报告。如果测试数据表被用来补充测试原稿,它们应该按照测试计划中的需求被批准。
文件执行
GEP测试中可接受标准的建立到完成的基本流程如图所示:
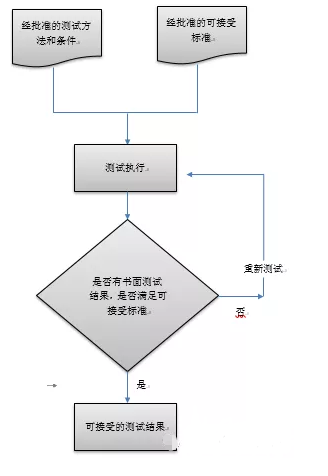
执行者资质和签名
填写测试文件的人(即执行人)必须具备教育、培训和经验,才能执行他们的工作,并将他们打印的姓名、签名和首字母记录在签名日志中。执行人不得复核或者批准他/她自己的工作。
同步记录
文件需在工作执行前完成,工作执行时需要进行同步记录。不允许进行回忆记录。应严格执行测试程序,另有规定时除外。如未按规定程序执行,需提供详细解释说明。如果一个测试项目需要多于一个自然天来执行,那么应该指明测试停止的地方,并在对应的测试步骤签名注明日期。
数据转录
允许将数据从一种形式转录到另一种形式(例如,打印手动输入汇总表或手动记录计算机的打印输出数据)。转录的数据应签名并注明日期。应包括原始数据的日期。转录的数据应由第二个人检查。如果数据是转录的,原始数据应贴标签、签名注明日期。
打印输出
测试步骤应指明何时使用打印输出。打印输出附件应加到测试计划/报告附录中,或包含在适当的参考文件中。如使用热敏打印纸进行打印(例如粒子计数器),则应由测试负责人进行复印,并在上面签名和注明日期作为真实副本。应在测试文件中添加备注,注明引用原始文件的位置。
支持性文件
需要有附录或参考文件。在转录文件被接收和批准前,应确保原始数据表或清单能被有效复核。在销毁GMP记录/文件的支持性文件之前,请参阅相关组织的要求或相关地法规中的有关规定。
文件的妥善处理
现场测试文件会被磨损是能够被理解和接收的。但是,应该加以保护避免文档缺损、过度折叠或其他物理损坏。
文件变更
批准文件的变更需要原批准小组的代表批准。
文章来源:允咨GMP制药技术
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。