扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 上周,我们提到美国 FDA 罕见儿科优先审评券将于 9 月 30 日到期,可能会获得暂时性为期 4 年的延期,但延期法案仍在立法流程中,并列出了自儿科优先审评券确立以来至今的全部优先审评券清单。【罕见儿科优先审评券将获暂时性延期,全部优先审评券情况一览 2020/09/11】
上周,我们提到美国 FDA 罕见儿科优先审评券将于 9 月 30 日到期,可能会获得暂时性为期 4 年的延期,但延期法案仍在立法流程中,并列出了自儿科优先审评券确立以来至今的全部优先审评券清单。【罕见儿科优先审评券将获暂时性延期,全部优先审评券情况一览 2020/09/11】
今天我们来看看临近儿科优先审评券法定到期日之前,FDA 收到的罕见儿科疾病认定请求趋势情况。FDA 孤儿药开发办公室(OOPD)主任 Janet Maynard 在9 月 14 日的监管事务专业协会(RAPS)2020 网络会议上表示,与 2019 年同期相比,在 2020 年前七个月中,罕见儿科疾病认定申请飙升 854%,达到 222 份。仅 2020 年 7 月,FDA 就收到了 110 份认定申请,超过了当月的孤儿药认定请求数量。而这也与之前的预测相符:【罕见儿科优先审评券认定请求可能出现激增 2016/12/26】
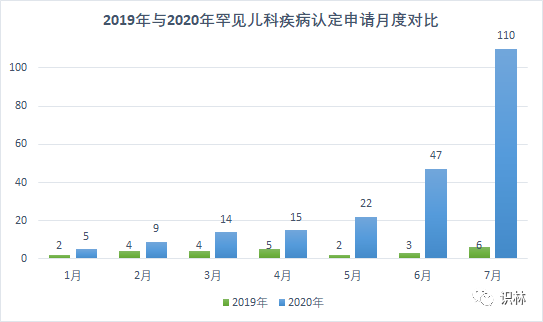
罕见儿科优先审评券计划旨在鼓励开发用于罕见儿科疾病的药物和生物制品。拥有罕见儿科疾病认定的药品申办人可以在产品获得批准后获得优先审评券。该审评券可以在将来用在另一产品上获得更快的审评,或者出售给其它公司。根据该计划当前的立法规定,申办人必须在 2020 年 9 月 30 日之前获得罕见儿科疾病认定,并且获得认定的产品需在 2022 年 9 月 22 日之前获批才有资格获得优先审评券。
在快速通道认定或孤儿药认定申请之后的两周内提交的罕见儿科疾病认定申请将会需要 60 天的审查。这意味着必须在 7 月 31 日之前提交罕见儿科疾病认定请求,到儿科优先审评券到期(9 月 30 日)之前,才能有 60 天充分的审查时间。FDA 表示,未与快速通道或孤儿药认定请求一起提交的罕见儿科疾病认定请求会得到及时审查,但 60 天的响应时间并不适用。
Maynard 表示,尽管 OOPD 和儿科治疗药办公室将继续审查所有认定请求,但他们不能承诺对 7 月份以后收到的请求作出答复。所以,这也就能理解为什么 2020 年前七个月(尤其是 7 月份)的罕见儿科疾病认定请求持续飙升。
值得注意的是,尽管 COVID-19 疫情导致了很多限制和延迟,但是并没有妨碍罕见儿科疾病和孤儿药认定申请数量每个月的增加。通常,罕见儿科疾病和孤儿药认定申请必须以纸质形式或 CD 形式提交到 OOPD。但是,FDA 可以采取措施,让申办人在 COVID-19 期间更容易地提交此类申请。在公共卫生紧急情况下,OOPD 将通过电子邮件接收认定请求和电子形式的提交。Maynard 表示,“重要的是,对于这些提交,申办人应该可以在两个工作日内收到一封确认邮件。如果没有收到确认邮件,请与 OOPD 联系跟进。”
尽管疫情使得申办人可以通过电子邮件提交,但孤儿药办公室仍在准备一种永久性的电子替代方法,以简化对孤儿药认定申请的提交。Maynard 指出,从 2012 年到 2016 年,孤儿药认定申请数量一直稳定增长,而过去四年每年超过 500 份。“鉴于工作量很大,我们将继续优化工具,以确保高效、准确的审查。”FDA 于 2017 年 6 月发布《孤儿药现代化计划》,旨在使授予孤儿药认定的流程现代化 , 并确保所有认定申请在 90 天内得到审查。Maynard 表示,该计划“重点在简化流程并启动对孤儿药认定审查的时间表。”
OOPD 正在此计划和 FDA 技术现代化工作的基础上,从基于纸质的认定提交流程过渡到新的基于云的提交门户。Maynard 表示“新的在线门户网站将允许申办人以电子方式提交孤儿药认定申请。我们预计门户网站将于今年晚些时候开放。”但是 , 在线门户将不会接收罕见儿科疾病认定申请的提交。Maynard 还表示,“除了基于云的外部门户网站外 , 我们还将实施新的工作流程管理工具。该工具将建立并促进在审查孤儿药认定请求提交过程中必需的路径,还将在审查和处理申请期间增强协作、集成和自动化。”
整理:识林-椒
文章来源:识林
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。