扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 1
1
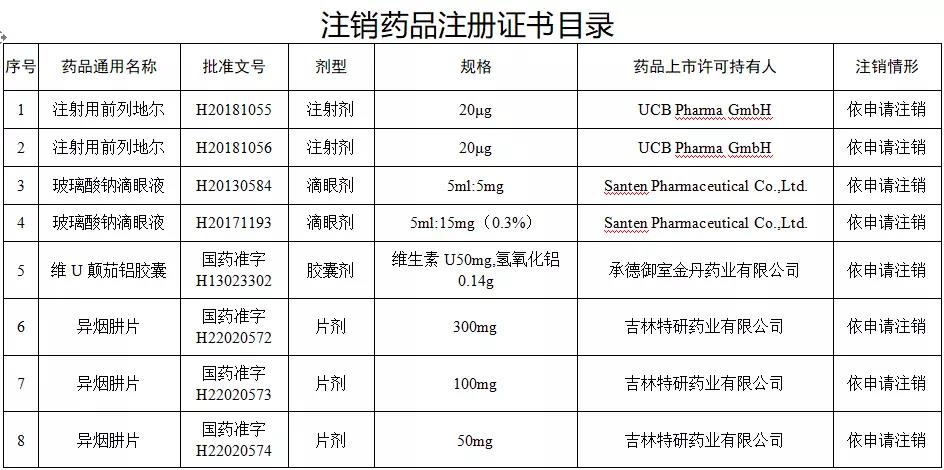
78个常用药,注销批文
9月8日下午,国家药监局发布《关于注销注射用前列地尔等78个药品注册证书的公告》(2020年第96号)。
公告指出,根据《中华人民共和国药品管理法实施条例》和《药品注册管理办法》的有关规定,国家药品监督管理局决定注销注射用前列地尔等78个药品注册证书。
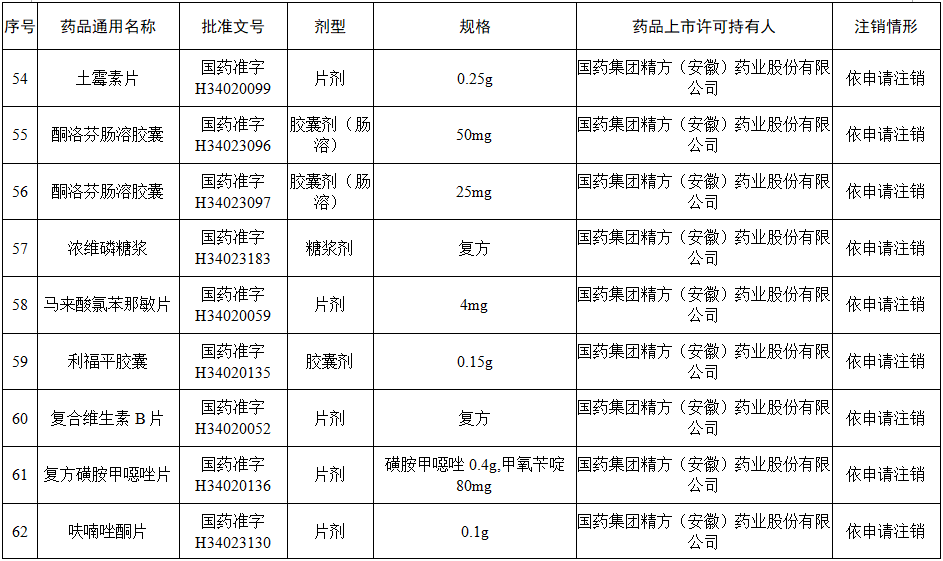
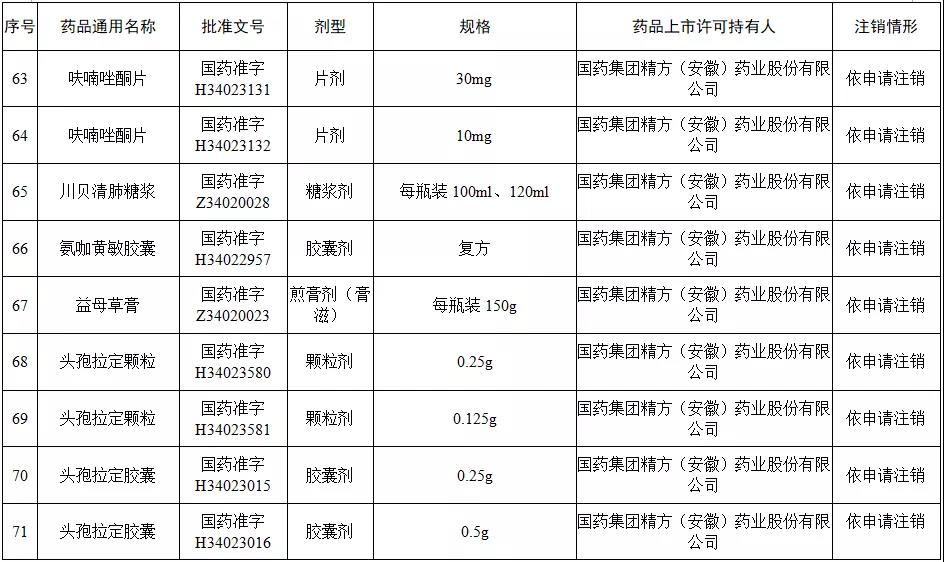
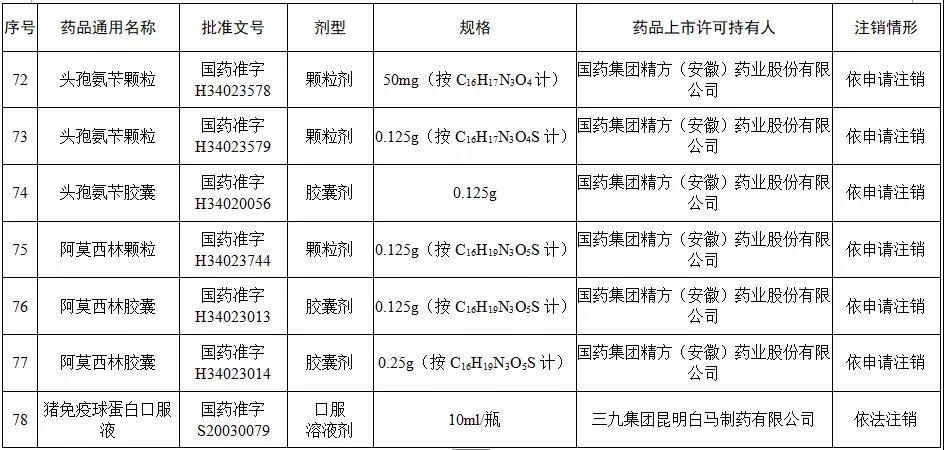
据赛柏蓝梳理,本次注销药品注册证书的药品有:小儿氨酚黄那敏颗粒、注射用前列地尔、马来酸氯苯那敏片、头孢拉定颗粒、头孢氨苄颗粒、阿莫西林胶囊、异烟肼片、银黄颗粒、盐酸雷尼替丁胶囊等常见品种。
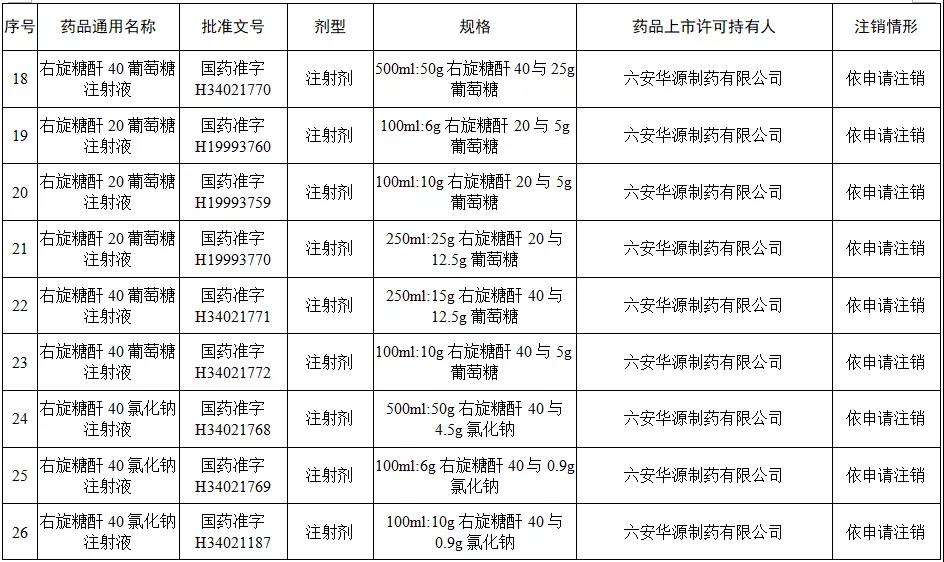
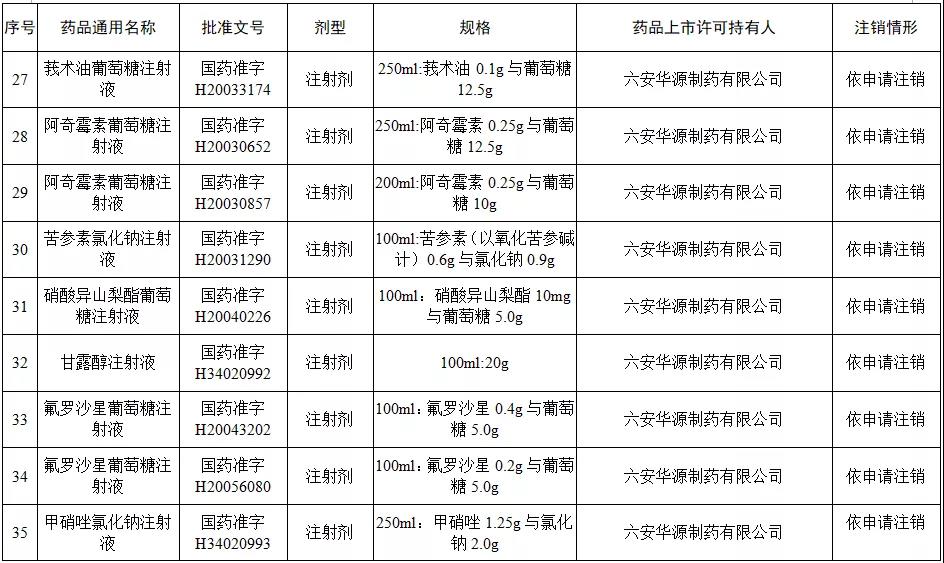
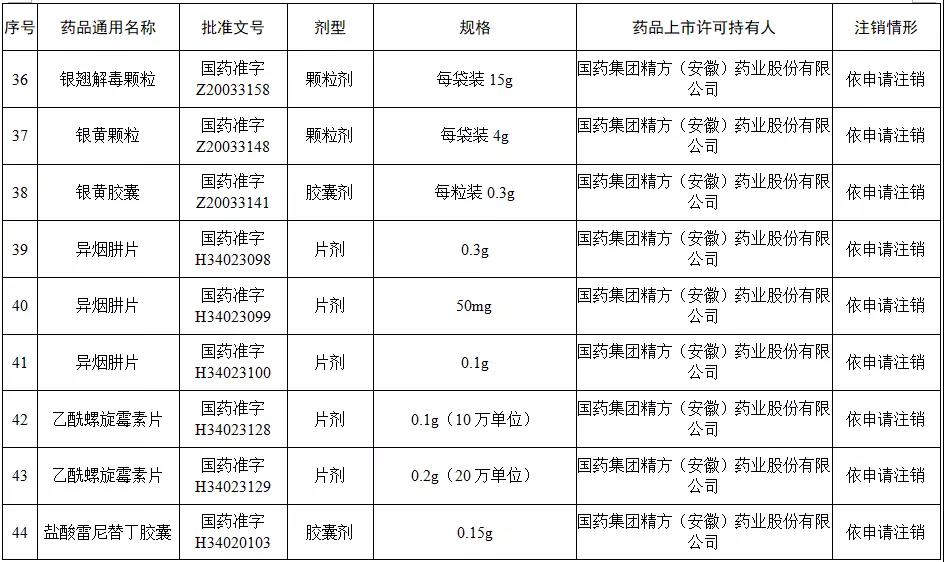
本次注销批文的78个药品主要涉及吉林特研药业、杭州胡庆余堂药业、六安华源制药、国药集团精方(安徽)药业、三九集团昆明白马制药等。
值得注意的是在上述药企中有两家药企注销的药品批文数量最多,一家是六安华源制药,一家是国药集团精方(安徽)药业——其中,六安华源制药注销的药品批文数量达21个;国药集团精方(安徽)药业注销的药品批文数量达42个。
另外,这78个药品除去3个不予再注册,一个依法注销外,其余74个药品均是依申请注销,也就是说是企业主动申请注销了持有的批文。
2
等同退出市场,不能用了
据赛柏蓝查询,根据新版《药品注册管理办法》规定,药品注册证书有效期为五年,药品注册证书有效期内持有人应当持续保证上市药品的安全性、有效性和质量可控性,并在有效期届满前六个月申请药品再注册。
根据《中华人民共和国药品管理法实施条例》,有效期届满,未申请再注册或者经审查不符合国务院药品监督管理部门关于再注册的规定的,注销其药品批准文号、《进口药品注册证》或者《医药产品注册证》。
今年7月1日起正式施行的《药品注册管理办法》第一百一十条规定,具有下列情形之一的,由国家药品监督管理局注销药品注册证书,并予以公布:
(一)持有人自行提出注销药品注册证书的;
(二)按照本办法规定不予再注册的;
(三)持有人药品注册证书、药品生产许可证等行政许可被依法吊销或者撤销的;
(四)按照《药品管理法》第八十三条的规定,疗效不确切、不良反应大或者因其他原因危害人体健康的;
(五)按照《疫苗管理法》第六十一条的规定,经上市后评价,预防接种异常反应严重或者其他原因危害人体健康的;
(六)按照《疫苗管理法》第六十二条的规定,经上市后评价发现该疫苗品种的产品设计、生产工艺、安全性、有效性或者质量可控性明显劣于预防、控制同种疾病的其他疫苗品种的;
(七)违反法律、行政法规规定,未按照药品批准证明文件要求或者药品监督管理部门要求在规定时限内完成相应研究工作且无合理理由的;
(八)其他依法应当注销药品注册证书的情形。
值得注意的是,根据新版《药品管理法》的规定,禁止未取得药品批准证明文件生产、进口药品。也就是说,上述批文的原持有药企将不能再生产上述药品,且自注销公告生效开始,已经生产的上述药品也将不能在市场上流通,否则将违反《药品管理法》的相关规定。


文章来源:GMP资料共享群
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。