扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 通常而言,病毒载体在研发领域和临床生产领域的目标以及对工具和技术的选择是有所区别的。操作一致性和生物负载控制等一些问题通常并不是大多数科研生产过程中的重点环节,但它们对临床生产而言却至关重要。下游纯化所面临的主要挑战是:如何在最大程度提高产量的同时,满足产品与杂质的质量规范。用于临床的病毒载体必须符合产品安全性和效力的监管标准,这意味着我们必须去除产品中的污染物并控制其中的杂质数量。
通常而言,病毒载体在研发领域和临床生产领域的目标以及对工具和技术的选择是有所区别的。操作一致性和生物负载控制等一些问题通常并不是大多数科研生产过程中的重点环节,但它们对临床生产而言却至关重要。下游纯化所面临的主要挑战是:如何在最大程度提高产量的同时,满足产品与杂质的质量规范。用于临床的病毒载体必须符合产品安全性和效力的监管标准,这意味着我们必须去除产品中的污染物并控制其中的杂质数量。
一、影响下游纯化工艺的主要影响因素
01 病毒载体物理特性差异
不同的病毒载体在物理特性方面差异很大,各种载体纯化的方法都会利用到病毒颗粒的物理特性,如尺寸、表面电荷和疏水性等。而各种载体在物理特性方面的巨大差异使纯化过程面临着形形色色的挑战。表 1 显示了以下常用病毒载体,即腺病毒 (AdV)、腺相关病毒 (AAV)、逆转录病毒(主要是γ逆转录病毒)(RV) 和慢病毒(一种逆转录病毒)(LV) 之间的一些异同点。
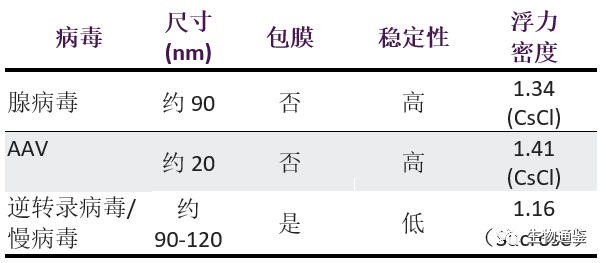
表1 四种常见病毒载体物理性质的异同点
这种物理特性上的差异不仅体现在不同的载体之间,而且体现在载体的各种血清型之间。这种差异可能很小(如 AAV 血清型间的差异),但却可能对下游工艺条件产生重大影响。此外,由于转基因插入片段存在差异,相同载体内的物理特性也可能有所不同。
02 工艺上的需求差异也带来了诸多问题
1)AAV 需要通过部分裂解过程在培养基中和细胞内积聚。细胞裂解量取决于具体的 AAV 亚型。为提高某些 AAV 亚型的产量,可通过表面活性剂进行细胞裂解。但这样的话,细胞裂解会显著提升宿主细胞污染物(包括 DNA 和蛋白质)的数量,从而增加纯化的负担。
2)如何去除不含转基因的“空”衣壳。空衣壳所占比例很高(可高达 95%),这进一步增加了操作难度。尽管我们尚不确定空衣壳是否能为 AAV 治疗带来益处,但仍需将其视为工艺相关杂质,也必须对其含量进行控制。另外,部分填充的 AAV 衣壳也是一种潜在的安全隐患。
3)RV/LV 载体在纯化过程中也面临着一些特有的问题。脂质包膜的存在降低了此类载体的稳定性,同时提高了它们的剪切敏感性。不稳定性会导致此类颗粒面临巨大的产量损失(可高达 70%)。LV 的半衰期仅维持 8-12 小时的情况并不少见。因此在设计下游工艺时,如何最大限度缩减用时(例如减少中间保存时间)将是一个至关重要的考量因素。
03 上游工艺选择为下游纯化带来的困难
1) 转染产生的载体上清液含有大量污染质粒 DNA
2) 使用悬浮细胞生物反应器所产生碎片的数量要多于固定床生物反应器,通常固定床生物反应器产品的浊度较低。这一点同样有助于减轻下游负担(尤其是澄清负担)。
3) 细胞内病毒所产生碎片的数量要多于分泌型病毒
4) 疱疹等大尺寸病毒可能无法通过过滤方式进行灭菌,因此可能需要无菌加工,并需要在加工后执行相关检验。
5)使用补加血清的细胞培养基也会加重纯化负担,而且血清粘度的增加会影响下游工艺的效率。使用无血清培养基(常见于搅拌釜式生物反应器)的上游生产系统可以有效减轻下游的纯化负担。
二、下游纯化一般工艺过程
尽管不同载体间的物理特性有所不同,这种物理特性上的多样性导致生产和纯化过程需要用到种类繁多的技术,这也给生产设备的开发和运营带来了挑战。但目前的下游方案通常采用相似的工作流程:澄清步骤(由于收获时需进行细胞裂解,可能需要额外进行深层过滤)、纯化(通常采用离子交换法或亲和层析法)以及精纯步骤(额外的层析法步骤/尺寸排阻)(如下图 1)。除上述步骤之外,我们通常还会利用过滤、渗析或 TFF 步骤来浓缩、交换缓冲液并生成最终配方。
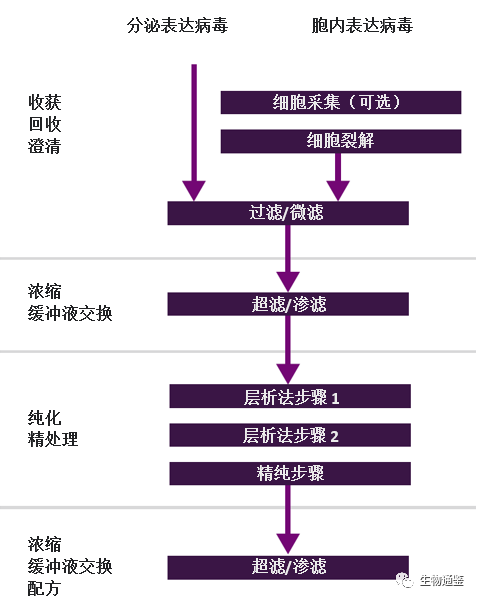
图1 下游工艺示例
病毒载体的选择将影响所需的纯化步骤。例如,AAV 纯化通常包括用于去除污染物的亲和色谱法步骤和用于分离空衣壳和完整衣壳的离子交换色谱法 (IEC) 步骤。LV 纯化主要涉及一个(有时需要两个)层析法步骤。
01 细胞裂解
当载体不能完全由细胞分泌(例如 AdV、AAV)时,通常需要通过细胞裂解来提高病毒产量。裂解可以借助微流化或热激处理所产生的物理破坏力来进行。此外,目前已证明 TritonTM X-100 等表面活性剂可有效裂解产生 AdV 和 AAV,且已将其用于昆虫细胞载体的生产。但是,欧洲 REACH 禁用物质清单中限制了对烷基酚乙氧基化物 (APE) 表面活性剂的使用(例如壬基酚聚氧乙烯醚 (NPE) 和辛基酚聚氧乙烯醚 (OPE),TritonTM X-100 也在限制范围之内),且相关组织已有计划于 2021 年对此类物质进行严格管控。
我们通常可以使用 TweenTM 来开发替代性的表面活性剂裂解方法,且可通过多种分析方法来检测载体制剂中的Tween 20,从而确定是否已将表面活性剂从下游加工工艺中去除。因为裂解过程对细胞浓度、培养时间、培养温度、细胞类型以及所释放的病毒存在高度依赖性,所以我们需要对一切细胞裂解方法进行优化。
02 澄清过滤
澄清过程包括初步去除细胞碎片和杂质,且通常需要将深层过滤器和无菌过滤结合使用。该方法同样有助于实施整体生物负载控制策略。为了提高回收率,一些澄清过滤采用了1 µm > 0.8 µm > 0.45 µm 直流过滤的解决方案。请注意,某些病毒(尤其是大包膜病毒)可能难以进行无菌过滤。还有一个关键因素:当下游收获流的浊度较高时,需采用标称孔径相对较大的预过滤器;这有助于去除掉较大的细胞碎片,使后续过滤器不会发生堵塞,从而避免它们在后续的纯化步骤中产生高压。对那些稳定性差的病毒而言,该过程的持续时间始终是一个重要问题。
03 层析法
与传统的离心法相比,层析分离法是一种适用于大规模生产重组腺病毒或 AAV 的、功能更为全面和强大的方法。另外,由于潜在外来病毒的物理特性可能与许多层析材料上的载体不同,层析法将成为去除此类病毒的一种有效手段。层析法的应用范围十分广泛,且适用于包括捕获、浓缩、纯化和精处理在内的许多下游步骤。
填料和膜均可以预填充的形式提供,且可能具有“即插即用”的优势。通常来说,确保填料的工艺经济性会更加困难;而这一点进一步推动了膜层析分离法的应用。膜吸附剂可与其他操作单元轻松集成,并可确保输出强大的下游生产力。如今,膜吸附剂越来越多地应用于对运行速度和稳健性能要求较高的新型弹性生产设备。此类吸附剂可以有效提升下游生产力;在某些应用中,它所带来的生产力提升要比树脂大一个数量级。此外,膜支持预填充(例如Pall的 Mustang® Q 膜),且具有成熟的可扩展性(已通过其多层膜方法证明,该方法可使每个床层深度保持相等厚度)。此外,约 0.8 µm 的较大膜孔径有利于病毒的纯化和 DNA 的去除。
1)亲和层析法(Affinity chromatography)
亲和层析法 (AC) 依赖于病毒颗粒与对靶点具有高亲和力,但对污染物没有亲和力的配体之间的相互作用。对于病毒载体,目前存在两种可用的亲和方法。肝素亲和法适用于 AAV 纯化,也已应用于 LV 和其他病毒的大规模纯化。使用低离子强度的溶液有助于保持载体的完整性。但是,还可能存在发生非特异性结合的杂质;要去除这些杂质,必须执行额外的纯化步骤。其他潜在的弊端包括配体需从动物身上提取,以及该方法存在对某些 AAV 血清型的优先选择性。CellufineTM硫酸纤维素 (AMSBIO) 是一种肝素替代品,对多种病毒的纯化具有相似的特异性。
AVB SepharoseTM亲和树脂 (Cytiva) 可有效利用重组蛋白配体,是制造商推荐的用于纯化 AAV 血清型 1、2、3 和 5 的有效策略。其他报告显示,该树脂可与其他血清型成功搭配使用,但使用效果可能存在差异。目前 AVB 树脂已成功与 IEC 结合使用,用于纯化各种 AAV 血清型。此外,POROSTM CaptureSelectTM AAVX 亲和树脂 (Thermofisher) 现已开发完成,且适用于大量血清型。
尽管这些亲和树脂帮助 AAV 纯化的研发工作向前迈出了重要的一步,但仍然存在一系列限制因素。其中包括:1) 配体可能渗入载体制剂,因此可能需要执行额外的分析检测或额外的纯化步骤;2) 空衣壳与完整衣壳之间缺乏特异性,因此需要采取离子交换色谱法等其他步骤进行处理。 3) 基于蛋白质的亲和配体不适合通过 NaOH 进行清洗。这会限制许多循环中的柱再生,从而加大树脂循环的难度。为了获得一些再生循环,我们必须进行大量的研究工作。因此,目前基于 AAV 蛋白的亲和树脂缺乏再生能力,而这会增加其使用成本。
2) 离子交换层析法 (Ion exchange chromatography)
离子交换层析法 (IEC) 是一种简单、经济且兼容性强的技术,目前已成为许多载体纯化过程中的关键步骤。阴离子 (AEX) 或阳离子 (CEX) 交换剂可分别用于结合带正电或带负电的病毒。IEC 既适用于键结/洗脱模式(例如病毒捕获或 HCP 去除),又适用于流穿模式(例如 DNA 去除),且在 DNA 和 HCP 去除过程中都能起到重要作用。IEC 具有高容量、高分辨率和高耐盐性等特点,因此尤其适合生物生产应用。
AEX 层析法适合 AAV 和 LV 加工。通常,LV 纯化需依靠单个 AEX 层析法步骤。慢病毒的尺寸较大,无法进入树脂孔隙;这使得膜层析分离法具有很大的优势。但这也降低了树脂的容量。尽管在洗脱步骤中使用高离子强度的溶液可能会降低 LV 的产量,但 AEX 可以直接从粗澄清的收获物中纯化出高纯度的 LV 载体。
IEC 还可用于从 AAV 制剂中分离出辅助病毒,例如 AdV 和杆状病毒。目前该方法已被应用于生成 GMP AAV 载体,AEX 对许多 AAV 血清型均有效,也被证明是适合大规模作业的有效方法。但目前,将 AEX 用于 AAV 空衣壳分离存在一个较大的难点,那就是我们需要针对每种单独的血清型优化操作条件,甚至有时需要在同一血清型的不同载体之间优化操作条件。这可能需要大量(长达数月)的开发时间来优化,才能实现分离所需的梯度。因此就目前而言,基因疗法发展过程中所面临的一项主要挑战就是,如何实现对 AAV 完整衣壳富集的优化。此外,在利用 IEC 从空衣壳负载较高(即 90%)的制剂中完全去除衣壳的过程中,经常会遇到技术难题。
有关 AAV 空/完整衣壳分离的最新进展中包括使用 Mustang Q 膜(Pall)来实现空衣壳与完整衣壳的分离。目前该方法正在申请相关专利,其中Pall发现,阶跃盐梯度的空/完整衣壳分离效果要优于线性梯度。此外Pall指出,可以将梯度减少为二阶,以降低在生产环境中实现此工艺的难度。因此,与 Mustang Q (Pall) 结合使用的效果表明,AEX 能够使用明显优于树脂的方式来实现 AAV 空/完整衣壳的分离。
3) 尺寸排阻层析法 (Size exclusion chromatography)
尺寸排阻色谱法 (SEC) 可根据尺寸和形状从污染物中分离出病毒颗粒。SEC 的优势在于它不涉及键结或洗脱,因此对颗粒的作用非常温和;同时该方法支持等度执行。但是,SEC 可能不适合大规模加工,原因在于负载通常不可能大于树脂体积的 10%。另外,生物生产中使用的 SEC 树脂为可压缩树脂,而这会限制层析柱的尺寸和流速。尽管如此,目前 SEC 仍被应用于许多病毒(包括 AAV 和 LV)的最终精处理。
4) 疏水作用层析法 (Hydrophobic interaction chromatography)
重组蛋白相关行业将疏水作用层析法 (HIC) 应用于病毒捕获/清除已有很多年的历史了。在纯化方案上,HIC 已被用于 AdV 和 AAV2 的纯化。但目前尚无大量资料表明,该方法可与不同血清型的 AAV 结合使用。HIC 同样面临着一些挑战。该方法在结合过程中需要使用高离子强度的溶液,而这会影响某些病毒的稳定性,因此必须另外开发出一个用于去除高浓度盐的步骤。通常而言,HIC 在当今载体下游工艺中的应用并不广泛。
04 浓缩/缓冲液交换
切向流过滤 (TFF) 在浓缩或缓冲液交换方面具有优势,其原因在于该方法具有可放大性,并可提供温和处理条件,适用于稳定性较差的载体。尽管通过此方法获得的浓缩系数通常低于离心方法,但此方法还有一个好处,那就是在浓缩过程中可以去除掉一些杂质。切向流过滤 (TFF) 是一种有效的澄清和浓缩解决方案,其回收率高达 90%以上。在浓缩和渗滤过程中,最大的问题是稳定性或功能性的丧失会导致病毒产量降低(对 RV/LV 载体等包膜病毒而言尤其如此)。对此我们可能需要开发出一些策略(例如限制流速或采用Single Pass TFF),从而将整个纯化过程中的剪切力降至最低;此类开发工作还在进行当中,且很可能有效提高产量。
切向流过滤 (Tangential Flow Filtration)
一般来说,市面上销售的 TFF 过滤器主要分为两类:平板膜盒和中空纤维模块。两种形式的产品目前都广泛应用于基因治疗领域。平板膜包的优点在于,此类产品的通量普遍高于中空纤维模块。此外,平板 TFF 还支持一种“模块化”使用方法:只需在过滤器支架中将更多膜包简单地“堆叠”在一起,即可有效增加过滤面积。我们通常认为,中空纤维 TFF 的剪切力要低于平板膜包,而这正是对脆弱的生物分子进行下游加工时的重要考量因素。慢病毒尤其容易受到剪切型损伤的影响。
大多数 TFF 膜具有较强的耐腐蚀性,且可应用于封闭的无菌工艺 - 而这一点正是基因治疗生产的一项关键考量因素。市面上几种较新的 TFF 产品(包括平板和中空纤维产品)都带有无菌性声明,且在某些情况下可以使用无菌连接器将其连接到系统中。这样即可在封闭加工优势不变的前提下,减少所需的冲洗量,从而减少操作员的工作时间和设备的占地面积。
最后,与单克隆抗体和许多重组蛋白相比,基因治疗产品通常对剪切力和时间等环境条件更为敏感,因此业界可能会继续研究Single Pass TFF(SPTFF) 技术。目前市面上已经出现了适用于单程浓缩和渗滤的产品,例如 CadenceTM在线浓缩器和在线渗滤模块(Pall)。上述技术可通过限制泵的通过次数来降低剪切力,并通过连续地组合操作单元来减少加工时间。
05 生物负载控制
整个生产工艺流程中的生物负载控制是保证生产符合 GMP 要求的关键一环,它可将最终产品受到微生物污染的风险降至最低。在大多数工艺流程中,最终载体制剂需通过一个或多个 0.2 µm除菌过滤器进行过滤(该过滤器为控制系统组件,其在下游方案中的具体位置可能有所不同)。由于病毒尺寸的原因,某些载体产品无法在 0.2 µm 的条件下进行除菌过滤。如果可以证明整个工艺流程完全无菌,则可以跳过除菌过滤环节;但是,这需要实现封闭式操作流程,且必须在洁净室中执行相关操作。TFF 系统可有效提高除菌过滤通量,并使整个生产活动从中受益。然而,目前除菌过滤对于一些稳定性差的病毒来说可能会是一个巨大的挑战,原因是此类过滤可能导致这些病毒丧失功能。
文章来源:生物通鉴
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。