扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

信息化系统改造与实施的外部压力
随着数据完整性的问题以及潜在的风险越来越多的被发现,数据的管理已然成了各药监部门关注的重点。MHRA、WHO、FDA、PDA等国际药监组织先后出台了数据完整性相关管理规范指南,中国NMPA也紧跟世界步伐,于2015年实施了GMP附录《计算机化系统》,更是分别于2016年10月、2017年8月、2018年1月三次修订发出了《药品数据管理规范(征求意见稿)》法规规范,可见国家药监局对加强计算机化系统管理以及整顿数据可靠性的决心。 很多药企已经意识到,人工纸质的记录由于容易修改,删除,伪造,从管理角度,要比信息化的电子记录更难满足《药品数据管理规范》的要求,同时也不能实现事后的大数据统计分析需求,因此,越来越多的药企已经开始开展质量管理信息化的建设工作。 除此以外,国务院办公厅于16年发布了《关于加快推进重要产品追溯体系建设的意见》,药监总局在16年至18年先后发布了《关于药品信息化追溯体系建设的指导意见》的两次征求意见稿及正式版。意见稿的中心思路是,药企必须从原料采购入库开始,到成品放行出库之间的所有流程,建设全方位以信息化系统为基础的追溯体系,这份意见稿的要求等同于硬性要求药企必须开始进行两化融合的建设工作,无形中对于药企提出更高的监管要求,从法规角度推进药企两化融合的实施进程。 进入19年以来《药品信息化追溯体系建设导则》、《药品追溯码编码要求》、《药品追溯系统基本技术要求》、《疫苗追溯数据交换基本技术要求》、《疫苗追溯基本数据集》、《疫苗管理法》等多部法规先后发布也证实了药监总局对于药品追溯体系建设的决心。 信息化追溯体系的建设,不是一蹴可及,需要至少3-5年的实施周期,且涉及多个系统的实施和集成,与计算机化系统验证。如果不及早开展工作,很可能无法满足法规的要求。1
信息化系统改造与实施的内部动力
越来越严重的行业竞争,药企的利润空间受到严重的挤压,进而对于内部管理的精细化和成本控制开始给予重视,对于药品的质量与良率也提出了更高的要求。 质量保证,质量控制,生产,物料,仓储等关键的GMP操作环节,依然采用人工纸质的管理模式,严重落后其他的制造行业。纸质模式不仅容易出错,可能会造成数据可靠性的严重缺陷,而且效率低下。信息化的管理模式不但可准确规范操作的合规性与一致性,并可大幅提高工作效率,降低工作成本,确保产品品质的均一性。 在近年来的FDA/EMA GMP现场检查时,越来越多的中国企业,遭遇国外检查官的质疑,询问为何不采用信息化的质量管理模式,虽然信息化质量管理不是欧美GMP的强制性要求,但其代表的意涵是,国外检察官越来越不信任人工纸质记录的数据可靠性,建议应采用信息化的质量管理模式,确保数据可靠性的法规合规性。国内药监局现场检查,也越来越重视计算机化系统特别是质量保证部门的数据可靠性。 在大数据时代,数据的统计分析至为重要,要提升产品质量,对质量体系持续进行改进,没有数据的支持,是不可能实现的。目前人工纸质的记录,无法支持大数据的分析,对企业未来的发展,形成了无形且严重的制约。 信息化质量体系,意味着所有的GMP数据都改采电子记录的方式,能支持实时的数据管理,汇总,统计,分析,有助企业找出质量体系的潜在问题,可积极主动的事先发现潜在问题并解决问题 (目前只能被动的等待问题发生再去想办法解决),可不断的提升产品质量,持续改进质量体系。1
信息化系统建设规划
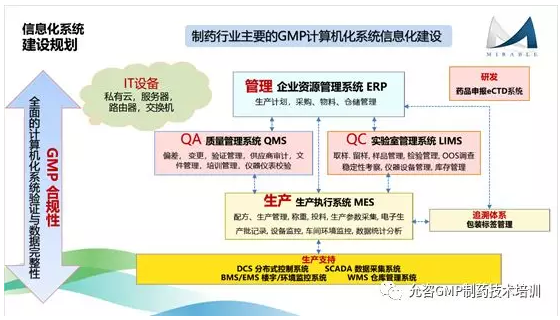
制药企业信息化改造建设涉及企业管理、质量、生产各个方面,与产品生产和放行息息相关,不可一蹴而就,不仅需要完善的规划,分步骤的实施,更需要企业首先打好“基础”----信息化相关的质量体系建设与相关的人员及部门规划。 信息化系统的体系建设不但需要有计算机化系统相关的使用、操作等规范,还需要完善数据完整性相关的管理规范。如迈本医药科技计算机化系统质量体系服务中提供的相关SOP就多达30余篇,不单是由法规与指南深层发掘而来,还结合了迈本专家顾问十余年的行业经验----规范且完善。
至于药企信息化改造建设的实施步骤,洛施德SISQP/plus EQM企业质量管理系统的专业顾问给出了以下意见:
两化融合中的信息化实施蓝图:
第一期 - 先实施文档管理DMS与培训管理TMS系统,这是两个相对实施周期较短,风险最小,可迅速提高文件与培训的管理效率,体现信息化管理的投资效益;
第二期 - 继续实施质量管理QMS与计量管理CMS系统,QMS是QA部门最重要的系统,等同于QA部门的大脑,本期工作可完善QA部门的信息化管理功能,可大幅提升质量体系管理的合规性与效率;
(备注:第一期与第二期的工作范围,QMS/DMS/TMS/CMS等四个系统可汇总理解为QA部门的质量保证系统,可合并实施)
第三期 - 实施实验室信息管理LIMS系统,可提升QC质量控制工作的合规性与效率,由于实施风险较高 (想象万一实验室管理系统宕机或是出错,对检验效率和产品出货会造成何等的灾难),不建议在第一期就实施,而在第三期再实施 (备注:LIMS可理解为QC部门的质量控制系统);
第四期 - 实施企业资源管理ERP系统,可对物料管理,仓储管理,设备管理等环节进行合规性管理,提升工作效率 (备注:ERP可理解为财务,销售,人事,物料,仓储,设备,运输等部门的管理系统);
第五期 – 最终实施生产执行管理MES系统,这是投资最大,实施周期最高,风险系数最高 (脑补一下生产线忽然停滞的灾难性场景吧) 的一个系统,企业只有在具备充分的信息化建设经验后,再实施MES系统,才能确保实施的成功率与效益 (备注:MES系统可理解为生产部门的管理系统,或是车间层级的管理系统);
文章来源:允咨GMP制药技术培训
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。