扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 在当前的新冠病毒大流行中,对于国内外各大疫苗生产企业而言,迅速开发和扩大疫苗生产规模的能力从未像现在这样重要。对于可以通过贴壁或悬浮细胞培养产生的新冠病毒的疫苗,开发和生产过程的优化是大家都比较关注的。例如,如何使用相同的过程设备优化细胞培养以生产更高的病毒滴度、如何在全球范围内使用较少的生产设施生产更多剂量的疫苗、如何在生产中降低总体成本等等诸多问题都有待我们去优化。疫苗生产企业应该开发什么技术来实现生产过程的优化呢?我们从新冠疫苗的开发与生产优化来说一说。
在当前的新冠病毒大流行中,对于国内外各大疫苗生产企业而言,迅速开发和扩大疫苗生产规模的能力从未像现在这样重要。对于可以通过贴壁或悬浮细胞培养产生的新冠病毒的疫苗,开发和生产过程的优化是大家都比较关注的。例如,如何使用相同的过程设备优化细胞培养以生产更高的病毒滴度、如何在全球范围内使用较少的生产设施生产更多剂量的疫苗、如何在生产中降低总体成本等等诸多问题都有待我们去优化。疫苗生产企业应该开发什么技术来实现生产过程的优化呢?我们从新冠疫苗的开发与生产优化来说一说。
文末有福利,记得看完喔!
全球新冠疫苗研发项目已有50多个,几乎涵盖了目前疫苗研究的所有形式,灭活疫苗、重组蛋白疫苗、病毒载体疫苗、核酸疫苗(mRNA 疫苗与DNA 疫苗)等,各类型疫苗类型的特点、研发机构及研发进展见下表1。

虽然疫苗生产企业在支持疫苗开发的生物过程和分析技术方面取得了重大突破。先进的工艺技术已帮助疫苗制造商快速、经济高效地获得稳定的产品纯度和质量。由于全球新冠疫情的快速增长,对疫苗开发和生产的研究和开发也在继续增加,疫苗研发的速度也前所未有的大大加快了,但是生物加工行业在这一领域仍然充满挑战和复杂性。
下图1显示了开发病毒疫苗开发过程的一般方法。工艺开发从实验室规模开始,确定工艺操作和参数,然后逐步扩大规模(通常为20 L发酵或细胞培养),以生产用于1期临床研究的符合GMP条件的疫苗。再放大到200L(通常用于2期临床试验)之前,使用实验设计(DoE)对关键工艺操作和参数进行过程确定和验证研究。在3期临床试验(2000 L规模)之前,需要进行过程验证和工程运行。在工艺开发和规模放大过程中,生产工艺必须进行生物物理、化学和生物表征的研究,以获取产品和工艺参数,以支持和证明产品的可比性和工艺可扩展性稳定性等。
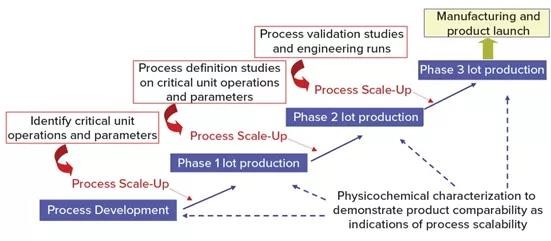
图1 病毒疫苗开发过程的一般方法
除了上述复杂的开发工作之外,疫苗生产企业还面临着高成本、高风险的商业环境,与其他主要疫苗生产企业的竞争,法规遵从性和安全性预期的提高以及技术驱动的高度复杂的生产工艺平台。开发和许可疫苗产品通常需要12到14年的时间,如下图2。
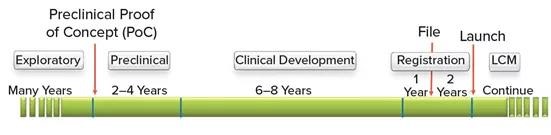
图2 疫苗开发的一般时间表(LCM =生命周期管理)
下面我们从下面几个方面谈谈新冠病毒疫苗开发与生产工艺方面的优化与挑战。
1.优化疫苗生物工艺的价值,为什么基于病毒疫苗的开发者应该考虑优化工艺?
与其他方法相比,生产过程优化可以允许使用更小的生物反应器。例如,我们一直在努力进行生产过程的优化,以高产量生产我们的冠状病毒候选疫苗,目标是从200L到2000L生物反应器中每批可以生产1000万剂以上。
生产工艺优化可以帮助降低每剂量的生产成本。这是因为工艺优化可以提高病毒疫苗的整体生产效率。此外,工艺优化强化不仅可以在上游实现更高的效价和更高的细胞密度,而且还可以提高下游生产能力,最大限度地提高设备产量并提高整体过程效率。这也确保了我们可以在大流行期间开发疫苗,例如我们现在面对的冠状病毒,因为集约化将导致在较小(如中试规模)的设施中快速生产大规模疫苗接种所需的剂量。
这很重要,因为疫苗需要进行长期的3期临床试验,生产企业必须在不知道疫苗是否有效以及是否将其投放市场的情况下生产大量疫苗。因此,他们需要一个灵活的制造平台。2期临床试验仅显示免疫原性,并且只能显示是否获得部分保护能力。
对于3期临床试验,企业必须扩大生产规模或转移到新的生产车间来生产3期临床试验样品,通常需要的20000—30000剂量。使用优化的生产工艺处理意味着试验设施可以提供3期临床试验阶段甚至商业化生产所需的所有疫苗样品。这就意味着降低了建立在3期临床阶段疫苗失败时不会使用的设施的风险,这与MAb(单克隆抗体)的3期临床试验阶段不同,单克隆抗体试验的患者人数较少,这是主要的MAb和疫苗临床研究与生产之间的差异。冠状病毒大流行也是一种特殊情况,在这种情况下,某些临床试验可能会被跳过或加速,从而需要迅速提供数千甚至数百万剂试验用疫苗样品。
2. 在优化细胞培养以生产病毒疫苗时面临的独特挑战是什么?
为了快速开发针对先前未知病原体的病毒载体疫苗,确保产量不受转基因抗原对病毒生产力的任何影响。选择具有细胞特异性高产量的细胞系是一项关键任务。
选择正确的表达系统很重要,并且取决于疫苗的类型。例如,对于抗原呈递疫苗,哺乳动物或昆虫细胞表达系统将是最佳选择。例如,对于冠状病毒,赛诺菲正在使用类似于其流感疫苗的杆状病毒表达载体系统(BEVS)。
选择合适的细胞系是优化生产加工工艺中的主要挑战,因为某些细胞系和克隆在优化工艺加工中的表现要好于其他细胞系和克隆。此外,关于如何增强CHO(中国仓鼠卵巢)细胞系的信息很多,但它并不是许多基于病毒疫苗产品的首选表达系统。细胞系优化这个过程也不同,因为细胞需要被病毒感染,并且整个病毒或病毒蛋白通常是被纯化之后用作疫苗的主要物质。例如,如果未严格监控过程条件,并且批次之间的pH,溶氧或温度存在细微差异,则即使在高细胞密度下,也可能会影响病毒感染细胞的能力并降低病毒效价。
培养细胞的研究首要关心的是存活率与浓度,对于面对细胞培养类型广泛的用户,全自动、高效、高通量的分析系统毫无疑问是替代传统人工方式的首选。贝克曼库尔特的Vi-CELL BLU细胞计数和活力分析系统,令培养细胞的研究工作踏入数码分析时代。Vi-CELL BLU以其高效及精确的分析,帮助全球的细胞研究者建立一个标准的细胞实验室平台,为其提供整体的细胞生物信息。在细胞筛选过程中,Vi-CELL BLU分析系统每次分析的体积相当于人工方法检测体积的15到30倍,因此Vi-CELL BLU的工作量相等于完成了传统工作方式工作量的15次以上,成功地提高了数据统计上的可靠性。细胞图像提供了更详细的描述细胞特性的信息:细胞存活率、数目、浓度、大小、圆度、细胞类型以及细胞直观图像的综合信息,分析报告的客观与专业水平亦明显增强。同时还可以通过分布曲线、细胞图像做出参数调整后再运算,适用于更多细胞类型。
全新的Vi-CELL BLU应用台盼蓝染色排除法(台盼蓝染色排除法是用于判断细胞存活率的经典方法,常结合显微镜、移液器和血球计数板等手动操作使用),结合全自动化的操作,完美地解决了生物制药和科研领域中细胞计数和活率的快速、准确、标准化分析。具备全自动样品制备、快速样品测量、更少样品量、仪器间高重现性、更大样品通量等特点。Vi-CELL BLU的分析能力也可以通过使用Vi-CELL MetaFLEX生化分析仪而进一步增强,MetaFLEX专门用于测量细胞的培养参数,比如pH、pCO2、葡萄糖和乳酸盐等。Vi-CELL BLU正在力争成为细胞计数和活力分析领域的前沿产品。
下表2列出了疫苗开发和生产中使用的不同细胞。包括多种疫苗产品,包括减毒活疫苗、灭活或解毒疫苗、亚单位疫苗、多糖、病毒样颗粒和蛋白质复合物。每种疫苗都有自己的复杂工艺以及适用的生化和生物学特性范围。

3. 当前有哪些方法可以改善上游生产工艺流程的效率,工艺中还有哪些要求?
显然,在小规模并行运行上游工艺条件的方法是可取的。在前期实验环境中,很难对我们的细胞系和培养基进行完整的DoE(实验设计)优化。我们仍然是在使用摇瓶,但我们希望使用诸如微型生物反应器系统之类的仪器。
生产企业,包括疫苗开发企业越来越多地接受并按照设计质量(QbD)原则进行开发。QbD强调过程理解和过程控制,这对于连续过程也是必不可少的,尤其是过程控制策略作为成功的连续制造的适当分析工具的应用,如下图3。
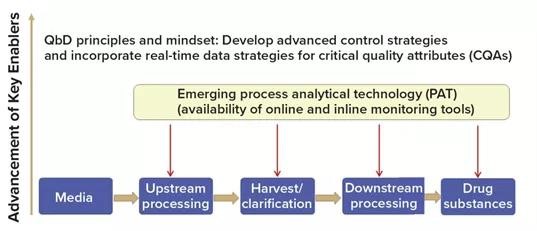
图3 使用质量设计(QbD)原理和理念为新冠疫苗制造奠定基础
灌注培养物确实会以高细胞密度产生生产病毒疫苗。但是,我们需要为此类过程设计专门的培养基成分。我们已经从现代的培养基形式中受益匪浅。我们相信我们不受细胞功能的限制,并且可以通过灌注培养进一步提高细胞和病毒的生产效率。近年来,越来越多的技术可用于支持连续的下游处理,如下图4。
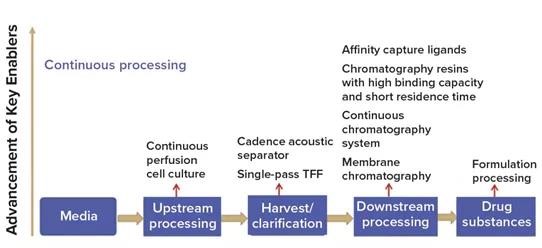
图4 连续制造关键推动因素的技术进步
现在,越来越多的供应商为上游工艺优化提供了一系列技术。可以根据基于MAb的方法和胰岛素生产方案来调整集约化疫苗生产工艺流程,从而降低总体风险。此外,我们现在拥有高通量的过程开发技术,可使用例如微型细胞培养系统在小规模上进行灌注优化。在大型生物反应器中,使用过程分析技术(PAT)工具进行良好的过程控制对于控制批次之间的pH等条件至关重要。诸如在线测量解决方案和与拉曼光谱仪集成的探针技术可以监视和控制设定点(进料控制和排放控制)和事件时间点预测(收获和感染),并及时识别过程偏差。然后可以使用多元数据分析软件分析生物反应器中细胞生长和感染的在线条件,以分析来自传感器的数据。这样就可以在一个方便的数据模型中汇总一系列工艺过程信息,关键参数的趋势、相关性和模式,从而可以更快地进行故障排除。
4.在收获和澄清的过程中,优化生产工艺将面临哪些挑战,以及如何克服这些挑战?
优化工艺过程使得产生的病毒滴度会增加,但是包括DNA和蛋白质碎片在内的杂质水平也可能会增加,这就需要额外的纯化步骤,当然这也会增加商品成本(COG)和降低产量。目前还没有足够的技术来应对高细胞密度,所以在优化疫苗的加工过程中,总要在产量和杂质之间进行权衡。
真正的瓶颈出现在下游纯化。高细胞密度需要去除更多的DNA以纯化病毒疫苗。最常见的选择是在过滤前使用核酸酶,但这是一种昂贵的生产工艺策略,因此每个人都在寻找替代方法以减少使用量。另一种选择是在下游纯化中使用大面积过滤器,但这需要缓冲液和较大的占地面积。
在牛津大学的新冠疫苗中,收获和澄清方面通常不会遇到很大的问题。我们将有兴趣探索替代核酸酶,但是在我们的工艺过程中,每剂疫苗的核酸酶成本非常低,而且我们有一个简单、有效的深层过滤步骤,并且产品回收率高。我们观察到的主要挑战发生在澄清工作的下游。
在某些冠状病毒疫苗生产中使用诸如腺病毒之类的溶解性病毒,我们可以使用絮凝剂,然后使用一次性离心系统进行离心分离,例如,在使用核酸酶之前将所有沉淀下来。具有低比吸收率的过滤器也可以用于澄清,因为许多病毒不会吸附它们。
当发现过滤器载量较低时,也可以使用大载量的过滤器。但是由于它们具有很高的正电荷,因此必须对诸如pH和盐之类的操作条件进行微调,以防止此阶段的病毒吸附。当前过滤器没有针对所有病毒疫苗的即用形解决方案。生产工艺需要测试不同的絮凝剂和过滤器,以找到适合其工艺的絮凝剂和过滤器。
5. 下游纯化还有哪些其他解决方案?
新冠疫苗的快速生产现在是主要的驱动力,减少缓冲区的数量对于在较小规模的车间中制造可能至关重要。在工艺优化处理中,如果必须使用大量缓冲区,缓冲成本可能会变得昂贵。因此,减少操作数量、减少材料成本和最终配方的成本至关重要。从优化细胞培养到纯化可能需要多个纯化步骤,但这会降低产量。正在开发一些最初用于纯化小型MAb(<100KDa)的层析介质,目前正在进行一些实质性工作,这对于纯化病毒疫苗似乎很有希望。
分析工作也可能是工艺中的瓶颈。我们需要一种高通量方法来测量病毒滴度,并在纯化步骤中检测产品质量以优化参数。缺乏良好的实时分析功能来帮助测量出口和入口病毒的浓度和质量是下游纯化的痛点。可喜的是,现在有许多PAT团队乐于对此进行进一步研究和优化。
在实验室条件下,小规模优化切向流超滤(TFF)工艺仍然很困难。更易于使用并行按比例缩小TFF测试方法将很有用,尤其是在具有较大规模性能的工艺预测性的情况下。
6.工艺优化还需要考虑其他哪些因素?
在紧急的实验中,多数情况常常没有时间去探索和做更多的研究。应用经济模型来确定哪些工艺流程可以进行优化改进可以带来最大的成本效益,这对于针对实际工作很有帮助。开发高滴度病毒疫苗时,重要的是选择正确的缓冲液和配方制剂进行纯化,小型系统使能够执行高通量缓冲液筛选。需要使用经过优化的原材料和进行超滤的方法,这些方法可以准备用于生产1期临床试验和2期临床试验的疫苗样品。
在最理想的条件中,我们设想可以在比较小的车间内生产病毒疫苗,和进行下游纯化的全封闭过程。但是,由于当前没有完全集成的生产工艺系统,工艺仍然需要找到正确的纯化方法并将其各个环节自身连接在一起,以成功进行整个工艺的优化处理。
总结
疫苗研发过程有其固有规律,制备出新冠疫苗是第一步,后续的临床前研究还需在动物模型中验证安全性、有效性;在确保安全有效的情况下才可以申报Ⅰ、Ⅱ、Ⅲ期临床试验,进而在人体中评价疫苗的安全性和有效性;在完成Ⅲ期临床试验充分证实疫苗的安全性、有效性后,这种新疫苗才能申请审批注册上市;批准后生产过程疫苗质量标准控制,每一步都要严格把关。
WHO在2020年2月的声明中给出了新冠疫苗可能在“18个月及以上”面世,这仍然是最乐观的估计。科学、严谨的临床前研究及临床试验确保新冠疫苗的安全性和
有效性仍然是必不可少的环节,也可能会存在很多不确定因素。此外,17年前,在SARS疫情结束后,企业和政府机构都对SARS-CoV疫苗研究失去了兴趣和需求,也减少了资助,许多疫苗研究也随之终止。如果我们现在有SARS-CoV 疫苗作为战略储备,应对2019‑nCoV暴发流行可能不会如此被动。
在2019‑nCoV疫情暴发的情况下,各国政府在新冠疫苗研发领域大力投入科研经费,并且启动应急疫苗审批。WHO也已建立涉及新冠疫苗研发各个环节的专项小组协调全球科研机构的研发人员通力合作,互通有无,在行政管理上为疫苗的研发一路开“绿灯”。相信有SARS和MERS疫苗研发经验教训的参考,以及全球科学家的通力合作及各国政府的政策支持,新冠疫苗的研发过程会大大缩短。
文章来源: 生物制品圈
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。