扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 概述
概述
在过去的十年中,细胞疗法,生物制造和合成生物学的进步推动了全球干细胞疗法行业的发展。干细胞治疗为原本没有治疗方法的患者开发了新的治疗选择——干细胞治疗。人或动物细胞是细胞治疗产品的关键和主要成分,干细胞治疗的目的就是替代或者再生患者体内功能失调或受伤的细胞、组织或器官。干细胞可以在向患者给药之前,在体外改变它们的生物学特性,从而达到更加精准和高效的治疗。现今,干细胞的治疗从传统的输血到自体干细胞移植,到最新的同种异体工程细胞治疗。
然而制造这些“活着的药物”的复杂性不容小视。每种产品在其开发、制造、分装和上市的每个阶段,都面临着特定的挑战和其不同的复杂性。在干细胞治疗领域,细胞原材料就显得尤为重要,细胞的来源、稳定的供应、细胞运输、制造、产品开发、治疗方案和治疗过程这些都决定了治疗方法的成败。
干细胞是一类能够自我复制并且能够分化为具有特定功能的细胞,具有发育全能性的细胞,干细胞主要分为胚胎干细胞和成体干细胞。目前用于干细胞治疗以成体干细胞居多,如骨髓间充质干细胞、表皮干细胞、子宫内膜干细胞、牙髓干细胞、神经干细胞、脂肪干细胞、角膜干细胞等,在干细胞治疗中也有使用胚胎干细胞作为种子细胞的研究。而诱导多功能干细胞(IPSC)与基因修饰干细胞作为治疗方法也极具应用潜力。
人间充质干细胞(human mesenchymal stem cells,hMSCs)成为各种干细胞治疗产品的基础技术。在过去的几十年中,对这些细胞进行了广泛的研究,由于其广泛的生物学功能,hMSC已在整个干细胞治疗中得到广泛采用。它们是具有多谱系潜能的多能祖细胞,可分化为中胚层来源的细胞类型,例如脂肪细胞,骨细胞和软骨细胞。另外,MSC可通过与人体适应性免疫系统相关的淋巴细胞相互作用而迁移到炎症部位,以发挥有效的免疫抑制和抗炎作用。而且人间充质干细胞(hMSCs)有易于分离和可离体培养扩大的特点,这为细胞治疗带来了可制造性和用于商业化广泛治疗的可能性。
1.间充质干细胞(MSC)的应用
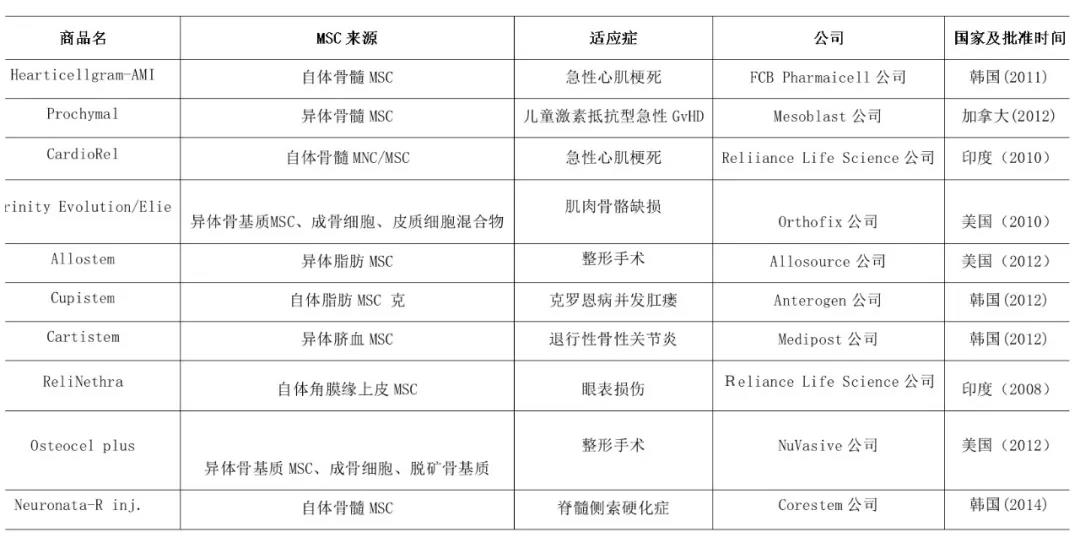
1991年,美国生物学家Caplan首次从骨髓基质的支持性组织中分离出一些成体干细胞,这些细胞具有分化成软骨、骨和脂肪组织的能力,并可为造血干细胞发育成各型血细胞提供所需信号因子,被命名为间充质干细胞( mesenchymal stem cell,MSC) 。在此之后,有大量研究报道了MSCs 具有分化多能性,可分化为外胚层( 如神经细胞) 和内胚层( 如肝细胞) 的多种细胞。目前,虽然各国均开展了大量的临床研究,但成功转化为商业化产品的数量很少,仅在韩国、加拿大、美国等批准了约10个上市产品(见下表1)。虽然我国尚未批准任何MSC商业化产品上市,但随着临床个体化干细胞治疗经验的不断积累,国产MSC的申报数量预期会逐渐增加。
表1 国外MSC产品的批准上市情况
2.干细胞疗法的质量法规要求
细胞治疗在我国主要存在2个开发途径,一个是在医疗机构中开展的,由临床医生主导的医疗技术类细胞治疗,属于医生对患者点对点治疗,一般由国家卫生健康委员会监管; 另一类是按药品开发和监管的细胞治疗产品,其用药人群更加广泛。
FDA CBER于2017年11月发布《Regulatory Considerations for Human Cells,Tissues,and Cellular and Tissue Based Products: Minimal Manipulation and Homologous Use Guidance for Industry and Food and Drug Administration Staff》,定义了无需按药品批准上市和需按照药品或医疗器械批准上市的人细胞组织来源的生物制品。
目前,我国药品监管机构颁布的涉及细胞治疗产品的法规和指导原则主要包括《药品注册管理办法》、《药物非临床研究质量管理规范》、《中华人民共和国药典》( 2020 年版) 、《人体细胞治疗研究和制剂质量控制技术指导原则》等。药学方面的技术要求可参考2017年12月颁布的《细胞治疗产品研究与评价技术指导原则》。
对按药品开发并监管的细胞产品,国际上要求其整个生产过程均需符合现行人体组织细胞优良操作规范( good tissue practice,GTP) 和药品生产质量管理规范( good manufacturing practice,GMP) 的要求,保证质量和批次间一致性。对活细胞制品来说,要实现对生物学特性的全面了解和控制是相当困难的,建议采用质量源于设计(quality by design,QbD)理念对整个生产过程进行质量控制: 研究者应对全工艺流程进行研究与验证,证明工艺的可行性和稳健性; 生产工艺设计应避免细胞发生非预期或异常的变化,并能满足去除相关杂质的要求; 建立规范的工艺操作步骤、工艺控制参数、内控指标和废弃标准,对生产全过程进行监控; 在此过程中,细胞质量控制、生产过程控制以及细胞放行检测应是结合互补的关系; 应根据临床需求和产品自身的稳定性状况设计产品的剂型和处方工艺。
3.用于临床干细胞制造的基本工艺
MSC产品的生产工艺是从供者体内获得组织细胞,直至成品细胞输入到患者体内的一系列操作过程,通常还包括细胞的冻存和复苏,研发者对其中的每一步工艺和操作均需开展研究和验证。
有学者将细胞库建立前的过程归为上游工艺,包括供者细胞采集和早期小规模体外培养; 而从细胞库复苏、大规模生物培养开始,包括细胞培养扩增、微载体分离( 如采用生物反应器工艺) 、纯化、浓缩、配制、细胞清洗、冷冻保存、批签发的生产过程被归为下游工艺。
影响 MSC 产品的质量因素很多。在体外培养过程中主要包括起始原料组织、细胞分离扩增方法、细胞接种密度、培养基和培养设备、培养添加物( supplement) 或生长因子,细胞数量和存活率、细胞群体倍增数等,应明确关键质量属性并进行控制。如为避免细胞高分裂率,EMA专家组建议将细胞体外传代次数控制在不高于20代次。
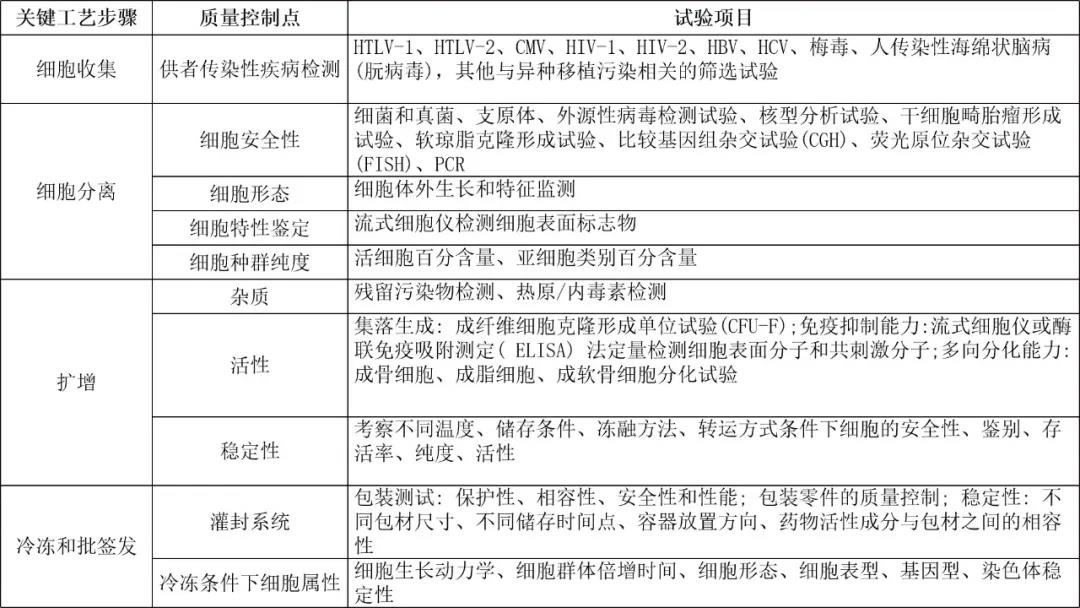
稳定性数据是支持MSC产品应用范围的重要依据。按药品开发的MSC产品,稳定性研究的基本原则除参照一般生物制品相关要求外,还应根据产品自身特点、临床用药需求以及保存、包装和运输情况设计合理的研究方案,同时需关注产品运输和使用过程中的稳定性。稳定性研究应能证明在拟定的存储条件下,产品的质量不会受到运输、使用或其他外界条件的影响。稳定性考察的项目和检测指标应根据产品自身的特点和存储条件合理设计。如冷冻储存的样品或产品一般应模拟使用情形( 如细胞复苏过程) 开展必要的冻融研究。考察项目建议涵盖生物学效力、细胞纯度、细胞特性、活细胞数及比率、功能细胞数以及安全性相关指标。生产过程中的关键工艺步骤和质量控制要素,见下表2。
表2 MSC 生产过程中的关键工艺步骤和过程控制要素
4.干细胞生产工艺流程的建立和优化
诱导多能干细胞( induced pluripotent stem cells,iPSCs) 是由体细胞导入外源基因去分化得到的,在性能上接近胚胎干细胞,下面我们从iPSC作为干细胞生产的建立为例来谈谈有关干细胞的制造生产。诱导多能干细胞为细胞治疗、基础研究、疾病建模和药物开发提供了巨大潜力,iPSC可以在体外产生、扩增、然后用于生产几乎任何成年细胞类型的临床级细胞。鉴于其自我更新的强大能力,它们作为当前良好制造规范(CGMP)操作的输入材料具有吸引力。
然而,为了使iPSC发挥其治疗潜力,有必要开发符合CGMP的iPSC制造工艺并应对与iPSC库的来源、特征和测试有关的挑战。
我们采取了循序渐进的方法来建立合规、可复制的、符合CGMP的iPSC制造流程。如下表3所示,这些步骤首先在原理证明中使用基于非融合的附加型技术建立了iPSC生成过程。在后续阶段中,我们基于关键流程属性执行了流程优化和协议开发。在中试扩大阶段,我们将该制造过程转移到了CGMP细胞疗法工艺中。在此iPSC制造过程的开发过程中,我们考虑了许多设计:
1、iPSC的重新编辑(例如,重编程方法的安全性和效率,供体之间的变异性以及起始材料的选择)
2、iPSC挑战(例如,开发用于iPSC生成和扩展,细胞敏感性和质量以及冷冻保存和复苏细胞培养系统)
3、安全性和质量控制挑战(例如,正常核型,残留质粒清除率,评估iPSC质量的过程控制,最终产品的关键属性以及标准安全性问题,例如无菌性)。
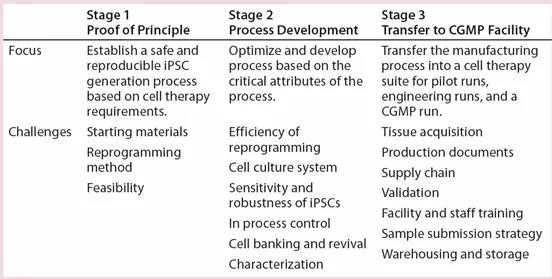
表3:使用从小到大的方法建立了可靠的、可复制的、符合CGMP的iPSC制造工艺。这是一个三阶段方法:(1)使用基础技术建立iPSC生成过程;(2)根据流程的关键属性进行流程优化和开发;(3)将制造过程转移到CGMP制造工厂。每个阶段都考虑了许多过程设计:起始材料的选择、基因编辑方法的安全性以及第一阶段的可行性、基因编辑的效率、用于iPSC生成和扩展的细胞培养系统的敏感性和稳定性、建立过程控制、细胞储存和复苏以及表征鉴定(阶段2)和细胞收获、生产文件、验证等等。
第1阶段:验证性实验
首先,我们重点研究iPSC的起始材料和iPSC生成方法的安全性。基于细胞获取和hiPSC产生有关的一些实际和技术问题,我们使用源自脐带血的CD34+细胞作为我们的起始材料。此阶段需要考虑的因素包括:获得经过同意的特性良好的脐血单元的可用性,脐带血在临床应用中的广泛使用,已建立的收集和存储协议以及从脐带血中相对高效快速生成hiPSC血液来源的CD34+细胞(与其他起始细胞类型相比)。之后在进行基因编辑,如下图1。
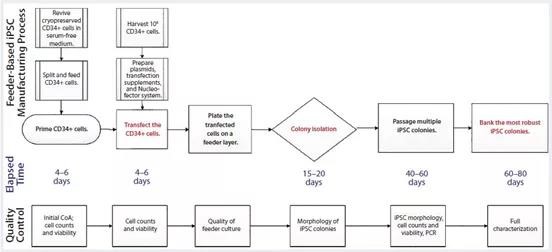
图1:人类iPSC生产是在基于小鼠胚胎细胞培养系统中使用基于附加型的编辑方法;图中显示了与其相关系统上的iPSC制造过程,其中包括处理时间(天)和质量控制活动,包括过程中间控制和最终表征。制造过程包括CD34+细胞的启动步骤、CD34+细胞的重新编辑和转染,将这些细胞在培养系统上、选择、传代、扩增和iPSCs细胞的储存。
使用pEB-C5和pEB-Tg质粒的组合(使用基于Lonza Nucleofector 2比色皿的转染系统)生成iPSC之后,选择了多个iPSC菌落(最少6个到10个),并在组织培养板上连续传代培养。基于饲养者的养殖系统。在这一阶段的工艺设计中,使用游离质粒使用多个供体(10个不同的人)分离的CD34+细胞,可再现生成高质量的iPSC。通过基于凝胶电泳的半合格聚合酶链反应(PCR)方法评估,在第8-10级通过iPSC时清除了这些蛋白(如下图2)。

第2阶段:工艺的开发
在工艺过程开发阶段,我们主要致力于基于培养系统来生成和扩展iPSC,以解决有关培养系统使用的担忧。我们通过结合增强剂来提高其稳定性并解决细胞培养系统中生长的iPSC的问题,从而努力提高工艺过程的效率。
多能干细胞(PSC)依赖于锚定并以具有确定边缘的完整细胞集落的形式生长。它们易于自发分化,而没有抑制这种现象的必要细胞培养要求。最关键的细胞培养要求是PSC可以附着和生长的适当底物,支持其增殖并防止自发分化的丰富培养基,以及在保持高活力和多能性的同时连续继代培养细胞的传代方法。
在干细胞生产工艺中,在细胞活率的检测中贝克曼Vi-CELL BLU的细胞计数平台有效的解决了细胞计数的问题。准确的测定反应器中的细胞密度激活率在过程检测与控制中尤为重要,多样、均衡的营养控制是维持细胞在体外健康生长的前提。动物细胞流加培养过程中,常用的控制标准是保证关键性营养成分的浓度控制在合理范围之内的基础。细胞活率及细胞浓度的准确是基础中的基础,营养成分控制的依据是确保细胞处于高表达率、延缓细胞坏死及较为一致的糖基化等理想的培养状态。自动化流加培养过程中,通常对营养物质的浓度、代谢副产物的积累及细胞密度等实施持续检测与控制,有助于细胞生长与目标产物的生成。Vi-CELL BLU可为其保驾护航。
下图3是最终CGMP兼容iPSC制造过程的示意图。与iPSC生成过程而建立的初始过程相比(图1),该过程花费了大约40天的时间,但其目的是保持设定的工艺过程设计的实现。在第4天(基于对CD34+细胞密度和生长的评估)完成CD34 +细胞的引发和随后的核转染,而不是在培养过程中进行核转染的4至6天完成。
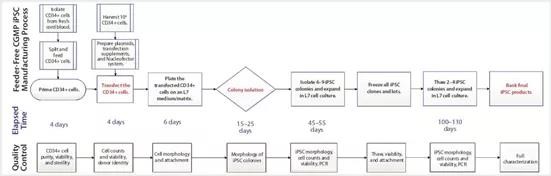
图4:符合CGMP的人类iPSC制造过程进行了概述,该过程在第2阶段结束时进行了优化,并具有处理时间(天)和相关的QC活动。该过程包括CD34+细胞的启动步骤,CD34+细胞的重新编程和核转染,将其铺在细胞培养系统上,使用细胞培养系统进行iPSC的集落选择、传代、扩增和保存。质量控制活动包括表征初始CD34+细胞,中间iPSC(基于质量和质粒清除率)以及基于既定的测试和标准进行最终表征。
阶段3:生产工艺的转移
在建立具有可重复的工艺流程的iPSC制造流程之后,我们致力于将工艺流程转移到CGMP设施中。从培训运行过渡到工程运行,再到CGMP制造运行,我们解决了许多制造挑战,包括组织获取、生产文档、供应链、过程验证、设施准备、员工培训、样品提交策略、仓储和存储。请注意,尽管在第3阶段对这些活动进行了重新评估和完成,但某些活动(例如,与组织获取和供应链有关)已在较早的阶段或与第2阶段的工艺流程优化活动同时启动。
此外,我们启动了平行的间隙分析和纠正过程,以识别原材料,中间体和最终产品表征中的缺陷,以最大程度地降低CGMP制造的风险。在干细胞生产报告中接受的评论,我们提供了将iPSC生产从过程开发转移到CGMP设施的研究细节和步骤。
在CGMP生产的iPSC的QC分析中,这些细胞符合多能干细胞的预定特征,包括复苏后的恢复,通过流式细胞仪测试的多能性标志物(Oct4,Nanog,Tra1-60,Tra1-81和SSEA4)的表达, EB的形成,遗传特性与通过STR分析,正常核型分析以及其他标准安全性测试(例如无菌,支原体,病毒安全性和内毒素测试)测试的起始原料的匹配性。
结果证实,我们的iPSC制造工艺是可靠且可重复的,并且可以根据CGMP准则进行操作,从而生成高质量的iPSC,用于制造用于细胞修复性移植策略的临床级专用细胞。我们已经证明,在我们过程的每个阶段(包括过程开发,培训和工程运行以及GMP制造运行)中生成的iPSC都可以满足多能干细胞的特性,这是通过标准和合格的检测方法进行评估的。Lonza的iPSC的CGMP生产工艺已通过药品主文件(DMF号BBMF-16567)提交给美国食品和药物管理局,在提交研究性新药(IND)申请时可作为参考使用。
5.面临的挑战
目前干细胞治疗虽然在临床试验中总体表现出较好的安全性,但是除了前文所述的生产工艺复杂、质量影响因素众多外,还存在不少制约其商业化发展的不利因素。
迄今为止全球范围内开展了大量的干细胞临床试验,适应证种类可称得上包罗万象,涉及关节炎、糖尿病、帕金森病甚至自闭症等,但是,还缺乏大规模、多中心、严格平行对照的临床试验数据证实其有效性。
众多临床试验普遍缺乏严格的临床前研究。临床试验用细胞的基因表达和分化
特性往往不十分明确,对治疗某适应证时应选择何种组织来源的细胞产品以达到最佳药效和安全性的相关研究也很不充分; 在临床试验中这些来源于众多不同部位成体组织的干细胞在患者体内是否能像治疗目的需要的那样向某种细胞分化通常难以证实。
总之,干细胞生物制品的商业化成药研发还处在起步阶段,研发者对按药品管理的细胞产品的研发思路和质量控制策略还缺乏深入的研究,监管机构对于干细胞产品的理解和认识也在累积的过程中。相信随着科研水平的进步和细胞治疗技术的不断成熟,在干细胞治疗领域的临床表现和应用前景将逐步得以明确。
参考文献:
[1]Thomson JA,et al.Embryonic Stem CellLines Derived from Human Blastocysts.Science 282,1998:1145–1147.
[2]Takahashi K,et al. Induction ofPluripotent Stem Cells from Adult Human Fibroblasts By Defined Factors.Cell 131,2007:861–872.
[3]Chen G, et al. Chemically DefinedConditions for Human iPSC Derivation and Culture. Nat. Meth. 8, 2011:424–429.
[4]Dowey SN, et al. Generation ofIntegration-Free Human Induced Pluripotent Stem Cells from Postnatal BloodMononuclear Cells By Plasmid Vector Expression. Nat. Protoc. 7, 2012:2013–2021.
[5]Rao M, Ahrlund-Richter L, Kaufman DS.Concise Review: Cord Blood Banking, Transplantation and Induced PluripotentStem Cell: Success and Opportunities. Stem Cells 30, 2012:55–60.
[6]Chou BK, et al. Efficient Human iPS CellDerivation By a Non-Integrating Plasmid from Blood Cells with Unique Epigeneticand Gene Expression Signatures. Cell Res. 21, 2011: 518–529.
[7]Baghbaderani et al. CGMP ManufacturedHuman Induced Pluripotent Stem Cells Are Available for Pre-clinical andClinical Applications. Stem Cell Rep. 2015: in press.
[8]CBER. Guidance for Industry: HumanCells, Tissues, and Cellular and Tissue-Based Products (HCT/P) — Small EntityCompliance Guide. Code of Federal Regulations Title 21, Part 1271. USFood and Drug Administration: Rockville, MD, August 2007.
文章来源:允咨生物GMP学苑
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。