扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 Caco - 2 细胞来源于人类结肠癌细胞,在常规细胞培养条件下,即可自发分化形成肠细胞样的细胞。与人小肠上皮细胞在形态上非常相似,具有相同的细胞极性和紧密连接,因此,可以作为研究药物的肠道渗透性模型[1]。
Caco - 2 细胞来源于人类结肠癌细胞,在常规细胞培养条件下,即可自发分化形成肠细胞样的细胞。与人小肠上皮细胞在形态上非常相似,具有相同的细胞极性和紧密连接,因此,可以作为研究药物的肠道渗透性模型[1]。
当使用Caco - 2细胞模型研究药物渗透性时,常采用两种取样方式。一种为间隔一定时间进行取样,计算不同时间点的累计释放量,以其累计释放量对时间进行线性回归,通过回归方程斜率计算药物表观渗透系数( Papp ) [2]; 另一种为在实验结束时,从Transwell小室单侧进行单次取样[3]。
为考察这两种取样方式对药物的Papp 测定是否存在差异,现采用已知高渗模型药物酒石酸美托洛尔、中渗模型药物阿替洛尔、以及未知渗透性分类药物甲硝唑作为模型药物,分别对两种取样方式测得的Papp值进行比较,为日后Caco - 2 细胞模型测定药物渗透性实验的取样方式提供参考[4]。
1
实验部分
1.1 仪器、试药与菌株
Countess II 细胞计数器( 美国Invitrogen) ; MERS00002 Millicell ERS - 2 细胞电阻仪( 美国Millipore) ; 20A 高效液相色谱仪( 日本岛津) 。酒石酸美托洛尔、阿替洛尔( 中国食品药品检定研究院,批号分别为: 100084 - 201403、100117 -201606) ; 甲硝唑( 广西金兴实业有限公司) ;Hank’s 平衡盐溶液( 北京索莱宝科技有限公司) ; DMEM 培养基( 美国Gibco) ; FBS( 上海中乔新舟生物科技有限公司) ; 青霉素- 链霉素双抗液、胰蛋白酶( 美国HyClone) ; MTT ( 北京百灵威科技有限公司) ; PBS 缓冲液( 北京中杉金桥生物有限公司) 。Caco - 2 细胞株( 美国模式菌种收集中心,批号: HTB - 37,传代数为30 ~ 40 代) 。
1.2 方法与结果
1.2.1 Caco - 2 细胞模型的建立与评价
将Caco - 2细胞培养于细胞瓶中,并置5% CO2、37 ± 1 ℃ 培养箱中,细胞所需营养物质为15%DMEM 高糖培养液( 含有15%胎牛血清、1%非必需氨基酸、1% 100 U·mL -1 青霉素G 以及100μg·mL - 1链霉素) 。待细胞生长至对数期后,采用灭菌后的PBS 缓冲液清洗,并加入0. 25%Trypsin - EDTA 消化液消化细胞,于1. 2 × 103 r·min -1 离心3 min,弃去上清液,并重新添加培养基吹打细胞,待细胞分散均匀后,对细胞进行台盼蓝染色并计数,以每毫升1 × 105 个的细胞密度接种于Transwell 12 孔板,其中,AP 侧为0. 5 mL 相应密度的细胞悬液,BL 侧为1. 5 mL 的DMEM 高糖培养液,置恒温培养箱中,连续培养21 d。接种后的前一周,隔天换液,一周后,每天换液,并测量扩膜电阻值( TEER 值) ,以跨膜电阻值来判定Caco -2细胞层的完整性,文献显示: 当Transwell小室内的跨膜电阻值≥220 Ω·cm2,可用于药物渗透性转运的模型[5]。记录实验前后的细胞跨膜电阻值,以判断实验结束后,细胞膜是否完整。实验前后的细胞跨膜电阻值见表1。
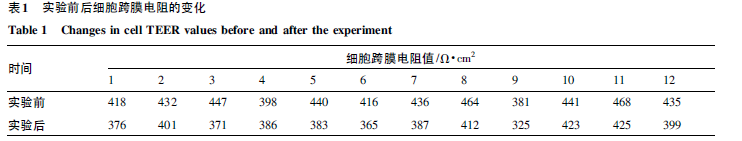
Caco - 2 细胞单层细胞的TEER 值大于300 Ω·cm2,据文献中报道,当TEER 值≥220 Ω·cm2时,表明单层细胞的紧密型和完整性良好,建立的Caco - 2 细胞模型满足要求,可以用于Caco - 2细胞转运实验。在实验前后,细胞跨膜电阻值虽略降低,但仍达到了单层细胞TEER值大于300 Ω·cm2 的要求,表明在实验过程中,细胞单层膜未被破坏。
1. 2. 2 安全范围的确定
采用MTT 法,将Caco -2 细胞以每孔5 × 103个细胞的密度接种于96 孔板中,在5% CO2、37 ± 1 ℃条件下培养,待细胞生长至对数期时,进行实验。分别设置空白组、对照组、实验组,每组设6 个复孔。其中,空白组为调零组,未接种细胞,仅用200 μL Hank’s 平衡盐溶液孵育; 对照组为200 μL Hank’s 平衡盐溶液,与空白组差异在于对照组接种细胞; 实验组为用200 μL Hank’s 平衡盐溶液配制的5、10、20、50、100、200 μg·mL -1系列浓度含药液( 含酒石酸美托洛尔、阿替洛尔、甲硝唑) 。在5% CO2、37 ±1 ℃条件下孵育3 h,弃去给药液及Hank’s 平衡盐溶液,避光条件下,各组细胞中分别加入200μL 0. 5 mg·mL -1 MTT 液,同等条件下孵育4 h后,弃去MTT 液,再加入150 μL DMSO 溶解生成的甲瓒结晶,采用酶标仪,测定570 nm 处的吸光度值( OD 值) ,并按照公式“存活率( %) =( OD实验组- OD空白组) /( OD对照组- OD空白组) ×100%”计算细胞的存活率。实验所涉及浓度的细胞存活率均> 80%,确定3 种药物混合含药液的安全浓度范围为5 ~ 200 μg·mL-1 [4]。
1. 2. 3 样品的前处理与色谱条件
在转运实验过程中得到的间隔取样细胞样品及单次取样细胞样品,均经过台式高速冷冻离心机,以1 × 10 4 r·min -1 离心10 min,取上清液,得到离心样品。采用Sepax Nu - 1Q C18色谱柱( 250 mm × 4. 6mm,5 μm) ,检测波长226 nm,流速1. 2 mL·min -1,柱温35 ℃,进样量10 μL。取27. 201 g 无水磷酸二氢钾加入160 mL DI 水中,用磷酸调pH3. 0,并用水补至200 mL,再与水以4∶71 比例混匀,即得3. 75 L 流动相A; 流动相B 为纯甲醇。梯度洗脱( 0 min、80% A, 15 min、60% A, 19 min、60% A,20 min、80% A,26 min、80% A) 。
1. 2. 4 专属性试验与标准曲线的建立
取混合对照品、酒石酸美托洛尔对照品、阿替洛尔对照品、甲硝唑及空白细胞等溶液,分别进样10 μL。空白细胞液对酒石酸美托洛尔、阿替洛尔、甲硝唑药物的检测均无干扰,且3 种药物之间无相互干扰。称取适量酒石酸美托洛尔、阿替洛尔、甲硝唑,配制9 个不同浓度的对照品溶液,酒石酸美托洛尔、阿替洛尔、甲硝唑的浓度范围分别为0. 82 ~ 135. 72、0. 43 ~ 65. 41、0. 88 ~ 133. 87 μg·mL -1 。取以上溶液,分别进样10 μL,记录色谱图,以进样浓度( μg·mL -1 ) 为横坐标、峰面积为纵坐标,绘制标准曲线,得回归方程分别为:Y酒石酸美托洛尔= 1. 3280 × 104 X -1 . 9966 × 103、Y阿替洛尔=1. 9318 ×104 X -2 ×103、Y甲硝唑= 9. 5248 ×103X -1 . 8813 × 103 ( r2均为0. 9999 ) ,0. 82 ~135. 72 μg·mL -1酒石酸美托洛尔、0. 43 ~ 65. 41μg·mL -1 阿替洛尔、0. 88 ~ 133. 87 μg·mL -1 甲硝唑与峰面积呈良好的线性关系。
1. 2. 5 进样精密度的试验
取任一对照品溶液,进样10 μL,连续进样6 次,测定峰面积。计算得酒石酸美托洛尔、阿替洛尔、甲硝唑峰面积的RSD 分别为0. 8%、0. 4%、0. 5%。
1. 2. 6 回收率的试验
精密称取适量酒石酸美托洛尔、阿替洛尔、甲硝唑,分别配制成相当于酒石酸美托洛尔、甲硝唑转运给药浓度的80%、100%、120%,50% 阿替洛尔转运浓度的80%、100%、120%,每个浓度配制3 份,分别进样10μL,计算3 种药物的回收率及RSD。酒石酸美托洛尔、阿替洛尔、甲硝唑的回收率分别为98. 36%、99. 15%、99. 23%,RSD 分别为1. 13%、0. 87%、1. 01%,回收率均为98% ~ 102%,RSD均< 2%,说明该方法的准确度较好。
1. 2. 7 稳定性的试验
取同一供试品溶液,在37 ℃下放置,分别在样品制备后的第0、0. 5、1、2、4、6 小时进样,测定峰面积。取同一供试品溶液,置室温条件下,分别在样品制备后的第0、1、2、4、6、8、12、24、48 小时进样,测定峰面积。计算得3种药物在37 ℃条件下和室温条件下的RSD 均<2%,表明含3 种药物溶液在37 ℃条件下6 h 内稳定性良好,在室温条件下48 h 内稳定性良好。
1. 2. 8 Transwell 转运试验
将培养至21 d 的Transwell 12 孔板用PBS 缓冲液清洗,洗涤2 ~ 3次,并在AP 侧加入0. 5 mL Hank’s 平衡盐溶液,BL 侧加入1. 5 mL Hank’s 平衡盐溶液平衡15min。之后将两侧Hank’s 平衡盐溶液吸出,并在AP 侧加入0. 5 mL 给药溶液( 酒石酸美托洛尔、阿替洛尔、甲硝唑均为100 μg·mL -1) ,并在Transwell板BL 侧加入1. 5 mL Hank’s 平衡盐溶液作为接收液,各设置3 个复孔,实验过程为120 min,于给药后20、40、60、80、100、120 min 时分别吸取200 μL 接收液作为间隔取样细胞样品,并及时补充等体积的空白Hank’s 平衡盐溶液。将培养至21 d 的Transwell 12 孔板用PBS 缓冲液清洗,洗涤2 ~ 3 次,并在AP 侧加入0. 5 mL Hank’s 平衡盐溶液,BL 侧加入1. 5 mL Hank’s 平衡盐溶液平衡15 min。
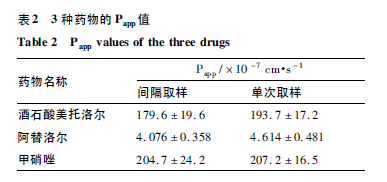
之后将两侧Hank’s 平衡盐溶液吸出,并在AP 侧加入0. 5 mL 给药溶液( 酒石酸美托洛尔、阿替洛尔、甲硝唑均为100 μg·mL-1) ,并在Transwell 板BL 侧加入1. 5 mL Hank’s 平衡盐溶液作为接收液,各设置3 个复孔,实验过程为120 min,于实验结束时,从BL 侧吸取200 μL 接收液作为单次取样细胞样品。采用“1. 2. 3”项下色谱条件,测定离心样品中3 种药物的浓度,根据公式“Papp = dQ/dt × A × C0 ”计算Papp( 表2) [7]。dQ/dt 为单位时间内药物的转运量,为药物累计释放量Q 对时间t 线性回归的斜率,A 为Transwell 12 孔板膜底面积,本实验为12 孔板,底面积为1. 12 cm2,C0 为AP 侧药物初始浓度( μg·mL -1) 。3 种药物的两种取样方式所得Papp 值均无较大差异( P > 0. 05) 。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
2
讨论
文中用MTT 比色法检测细胞毒性,通过活细胞线粒体的琥珀酸脱氢酶将MTT 还原成蓝紫色结晶甲瓒,用DMSO 溶解甲瓒,测定OD 值。其OD 值越大,说明生成的甲瓒越多,药物产生的细胞毒性越小[8]。确定细胞的安全范围后,排除细胞浓度对Caco - 2 细胞模型造成损伤的可能性,使实验结果更准确。间隔取样和单次取样为Caco - 2细胞模型验证药物渗透性的两种常用取样方式,现被多数研究者采用。在不同的药物转运实验中,间隔取样应用较多。间隔取样为通过在不同时间点进行取样,计算不同时间点的药物累计释放量,并对时间进行线性回归,计算回归方程的斜率,从而得到表观渗透系数( Papp ) 。
间隔取样的取样量较多,因此,在后续样品处理及检测方面,工作量较大; 且在取样的过程中,细胞孵育环境发生改变,不能保证实验过程中,细胞均处于37 ℃、5%CO2的孵育环境下,且在取样过程中,因在同一时间点对全部实验孔进行操作,细胞在外界环境中所处时间较长,对细胞活性的影响未知。且在间隔取样过程中,操作烦琐,易出现忘记在接受池中补加接收液或多加接收液,此外,多次取样、补液,会更易引起实验偶然误差。但间隔取点在一定程度可以规避某个时间点的偶然性。单次取样方式优点在于取点较少,在样品检测过程中,可大大缩短样品处理及检测所用时长。经研究比较,酒石酸美托洛尔、阿替洛尔、甲硝唑经间隔取样测得的Papp 值和经单次取样测得的Papp 值差异较小,且两种取样方式测得的Papp值差异均无统计学意义。文中数据可为Caco - 2 细胞模型验证药物渗透性实验中的取样方式提供参考。
文章来源:凡默谷
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。