扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 美国 FDA 药品审评与研究中心(CDER)于 1 月 25 日发布了其 2021 年药品方面的指南制定计划,涵盖 18 个类别,共 105 篇计划新增或修订的指南,比去年 2020 年计划的 88 篇文件增加了 18%,其中 42 篇是 2021 年的新指南,剩余的则是从 2020 年的计划清单中遗留下来的。和去年一样,计划发布的指南大部分涉及仿制药、药品质量/CMC 和程序性工作,不过仿制药和程序性工作两个类别中保留了大部分上年度甚至是 2019 年度未如期发布的指南。
美国 FDA 药品审评与研究中心(CDER)于 1 月 25 日发布了其 2021 年药品方面的指南制定计划,涵盖 18 个类别,共 105 篇计划新增或修订的指南,比去年 2020 年计划的 88 篇文件增加了 18%,其中 42 篇是 2021 年的新指南,剩余的则是从 2020 年的计划清单中遗留下来的。和去年一样,计划发布的指南大部分涉及仿制药、药品质量/CMC 和程序性工作,不过仿制药和程序性工作两个类别中保留了大部分上年度甚至是 2019 年度未如期发布的指南。
实质性证据标准指南
临床/医学类别列出了 13 篇指南,其中只有 4 篇是从 2020 年计划中顺延下来的,另外 9 篇是新出现在这份清单上的。其中值得注意的一篇指南是《满足基于一个充分且良好对照的临床研究以及确证性证据的实质性证据标准》指南。该计划发布的指南标题是 2019 年 12 月发布的一份指南草案《证明人用药品和生物制品的有效性的实质性证据》中的第 IV.B 小节的标题。【FDA 就证明药品有效性所需的实质性证据提供更多灵活性 2019/12/23】
在 2019 年这份指南草案的该小节中,FDA 介绍了在确定依赖单个充分且良好对照的临床研究加上确证性证据是否合适时应考虑的因素。指南草案进一步解释了确证性证据可能包括:相关疾病领域的研究,真实世界证据,机理证据以及疾病自然史。2019 年的指南中包括四个例子,证明一个单独的充分且良好对照的研究何时可以建立有效性证据:
对已获批药品的新适应症进行一项充分且良好对照的临床研究 , 并辅以已证明药物对其它紧密相关的获批适应症的有效性的现有充分且良好对照的临床研究;
一项充分且良好对照的临床研究,并提供强有力的机制支持的数据;
一项充分且良好对照的结果令人信服的临床研究 , 并有该疾病自然史的其它数据支持;
一项关于新药的充分且良好对照的临床研究,以及有关相同药理学类别其它药物有效性的科学知识的支持。
在罕见病背景下,经常会出现有关通过一个充分且良好对照的试验来证明实质性证据是否可行的问题,因为罕见病的特性,可能难以进行多个随机试验。
真实世界证据
CDER 计划在 2021 年制定三篇真实世界证据相关的指南文件:
真实世界数据:评价电子健康记录和医疗索赔数据以支持药品和生物制品的监管决策
使用真实世界数据和真实世界证据来支持药品和生物制品监管决策的监管考量
使用登记(registries)作为真实世界数据源用于 FDA 申报
根据《21 世纪医药法案》,FDA 在 2018 年 12 月发布了真实世界证据框架,但直到 2021 年 12 月才会发布有关真实世界证据做出监管决策的指南草案。【FDA 对在真实世界证据框架中使用观察性研究犹豫不决 2018/12/21】到目前为止,FDA 仅发布了一篇针对药品和生物制品的真实世界数据/证据指南草案,指南解释了申办人应如何确定将此类证据纳入产品申请中。【真实世界证据支持申请批准的时代已经到来?2019/05/20】
在昨日的资讯中,我们介绍了 FDA 首席副局长 Amy Abernethy 表示,新冠疫情正迫使 FDA 和药品开发者更快地适应真实世界数据集。【疫情加速 FDA 对真实世界数据的使用 2021/01/28】
个体化治疗,生物类似药
2021 年的指南制定计划还包括针对严重衰弱或危及生命的疾病的个体化反义寡核苷酸药物产品的三篇指南,计划发布的这三篇指南将解决:
支持研究性新药申请申报的临床建议;
化学、生产和控制方面的考量(也出现在 2020 年的指南计划中);
非临床测试。
本月初,CDER 发布了一篇关于个体化反义寡核苷酸药物研究用新药(IND)申请的程序建议指南。【FDA 发布个体化反义寡核苷酸药物申报的指南草案 2021/01/05】
2021 年的指南计划清单中还列出了与生物类似药有关的四篇指南 , 其中包括首个可互换生物制品专营权的指南,以及针对开发生物类似药和可互换生物产品的具体产品类别的建议。FDA 还计划制定有关生物参照产品和生物类似产品的促销标签和广告注意事项的问答文件,以及对 2018 年 7 月生物类似药产品标签定稿指南的修订。
仿制药
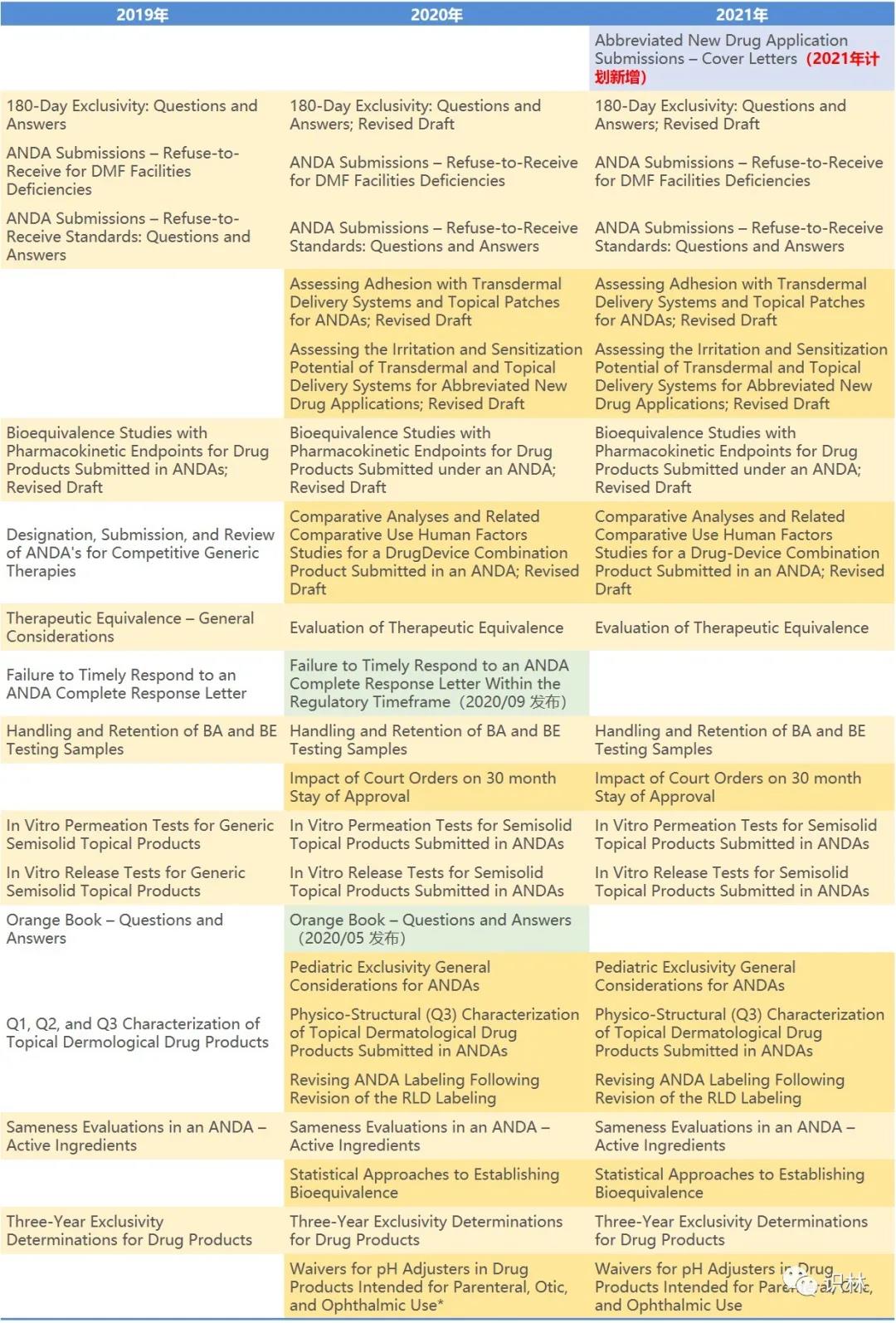
2021 年指南计划清单中列出的指南数量最多的是仿制药类别 , 共计划发布 20 篇指南,但是其中仅有一篇是 2021 年计划新增的 , 而另外 19 篇是在 2020 年指南计划上但未如期发布的指南。通过下表可以一目了然的看出哪些指南拖延了多年仍未发出,这些未如期发布的指南中相当多是业界极为关注的内容。
作者:识林-椒
文章来源:识林
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。