扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 药品检验是药品质量控制的关键环节,贯穿于药品整个生命周期,每个药品都必需包括必要的分析方法以确保药品的质量。必须要有资料证明所用的分析方法符合一定的准确度和可靠性要求(21CFR 211.194(a)(2))。
药品检验是药品质量控制的关键环节,贯穿于药品整个生命周期,每个药品都必需包括必要的分析方法以确保药品的质量。必须要有资料证明所用的分析方法符合一定的准确度和可靠性要求(21CFR 211.194(a)(2))。
方法验证是证明目标分析方法符合预期要求的证明文件,它并非一次性事件,应遵循生命周期方式,方法验证始于实验室方法开发,终于方法退役,应确保方法在生命周期中符合所需的标准。
1. GMP对分析方法验证和确认的要求
分析方法是为完成检验项目而设定和建立的测试方法,它详细描述了完成分析检验的每一步骤,一般包括分析方法原理、仪器及仪器参数、试剂、供试品溶液与对照品溶液等的制备、测定、计算公式及限度要求等。
方法验证是一个正式的,存档的证明文件,证实一个测试程序用于某个预期用途的能力。方法验证应参照书面的、经过批准的方案或计划执行,该方案或计划应明确验证的可接受标准。
国内外cGMP对分析方法验证的要求如下:

关于分析方法验证或确认的主要指南如:
• ICH(人用药品注册技术要求国际协调会)Q2(R1) 分析方法验证
• 美国药典 1225 药典规程的验证
• 美国药典 1226 药典规程的确认
• 美国药典 1244 分析方法转移
• FDA 工业指南 药品和生物制品分析规程及方法验证
在USP<1225>以及FDA 工业指南 药品和生物制品分析规程及方法验证中对于分析方法的生命周期管理进行了描述。USP-PF公布的通则1220分析方法生命周期的草案中对于分析方法的生命周期的定义分为3个阶段:
第一个阶段 方法设计阶段:基于QTPP和产品CQA以及过程控制要求的基础上确定分析目标概况(ATP)和方法关键性能特性,并进行方法开发和理解方面的活动。首先,选择能满足ATP要求的适宜分析技术和方法条件进行方法开发,一般包括分析方法原理,仪器及其参数,试剂供试品溶液和对照品溶液等的制备,测试过程,计算公式及范围限度要求等;然后,基于先前知识和风险评估,进行合适的实验研究(必要时采用DOE),以理解需控制的材料属性和方法参数及其与方法性能特性之间的关系,确保方法的耐用和稳健。最后,开发和定义一系列预期能满足ATP的方法条件和控制措施,以建立方法控制策略。第一阶段的内容不在本章节讨论范围。
第二个阶段 方法性能确认 方法性能确认就是采集并评价来自于方法验证阶段的数据和知识,建立证据表明该方法可提供高质量的分析数据。只有经过确认的方法才能用于物料和产品的检验,也才能可靠地用于产品的内在质量控制和过程分析。
第三个阶段 持续方法确证 持续方法确证的目的是持续确保建立的分析方法在日常使用中能保持在受控状态。包括周期性检测和回顾,变更控制及再验证等的实施。
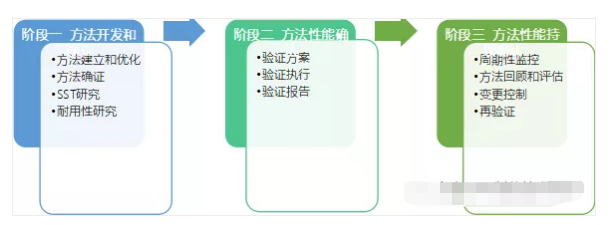
图1-1分析方法的生命周期
分析方法生命周期管理的应用能够保证测试方法在使用周期内持续符合法规和技术要求,对贯穿于药品生命周期的测试活动实现质量保证,同时提升药品生成商对质量控制数据的信心。
文章来源:允咨GMP制药技术
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。