扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 为贯彻实施中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)的有关要求,加快药品审评审批信息化建设,推进药品按照电子通用技术文档(electronic Common Technical Document)要求进行申报和受理,我中心组织起草了《eCTD申报指南(征求意见稿)》,现向社会公开征求意见。
为贯彻实施中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)的有关要求,加快药品审评审批信息化建设,推进药品按照电子通用技术文档(electronic Common Technical Document)要求进行申报和受理,我中心组织起草了《eCTD申报指南(征求意见稿)》,现向社会公开征求意见。
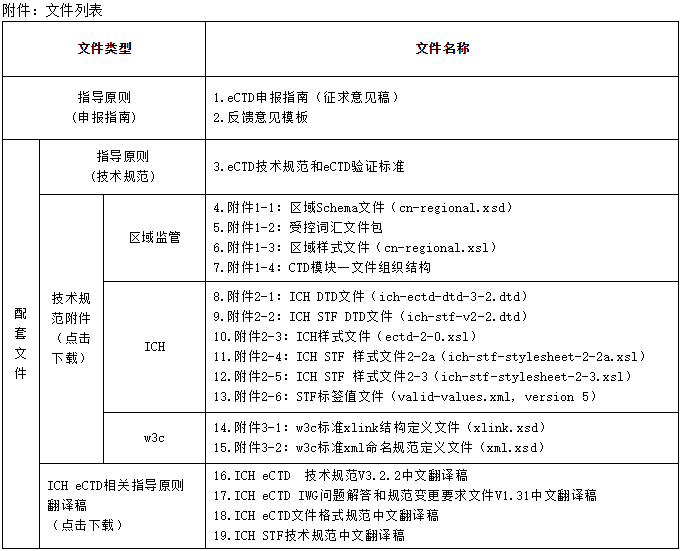
为了对《eCTD申报指南(征求意见稿)》进行完整的评估和反馈,本次征求意见同时使用了我中心正在开展的一些过程性文件,具体文件列表详见附表。这些过程性文件仅作为本次征求意见的技术支撑文件,后续我中心将随着工作推进,根据CTD模块一的正式发布和研究讨论进一步修改完善,发布最终正式稿,敬请关注。
请将建议和修改意见按照《反馈意见模板》要求于2019年10月17日前通过电子邮件反馈至我中心。
联系人:殷翠香
电子邮箱:yincx@cde.org.cn
国家药品监督管理局药品审评中心
2019年9月17日
文章来源:GMP行业新闻
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。