扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

周五(3月13日),美国FDA发布了有关其竞争性仿制疗法(Competitive Generic Therapies,CGT)的指南定稿,该指南描述了仿制药申请人应遵循的程序,并界定了CGT的流程和标准。
背景
一些品牌药物可能无法吸引仿制药制造商足够的兴趣,或者因为药物本身太复杂导致仿制难度较大。FDA正在努力减少仿制药物开发的一切障碍,降低仿制药物进入市场的成本,以刺激患者增加对此类药物选择的信心。作为降低处方药价格的一种手段,FDA一直在积极地推动增加仿制药竞争。
依据2017年颁布的FDA重新授权法案(FDARA),若一种药物在“橙皮书”(FDA批准的药物产品与治疗等效性评估)的“active section”部分仅有不超过一种的批准药物,则说明其仿制药竞争不充分,该药物即可以获得CGT资格。获得CGT资格的药物,可以通过简化新药申请(ANDA)增强和加快审查。这一新的途径是该监管机构在美国增加药品竞争和降低药品价格努力的一部分。
指南定稿的意义
对于该指南定稿的意义,FDA局长Stephen M. Hahn表示:“激烈的竞争有助于患者获得更多的医疗选择。对于目前竞争很少或没有竞争的非专利药的开发,该指南提供有效的激励措施,我们将能够更好地促进更安全有效的非专利药开发,我们希望这将增加获得必要治疗的机会,并可以降低这些药物的费用。”
“特别是,在帮助加强美国仿制药竞争方面,竞争性仿制药CGT资格取得了重大进步。自国会获得授权以来,我们已经收到了药品制造商提出的350多项CGT要求,并进行了相应的批准。”
“鼓励竞争不充分的药物的仿制药需要进入市场,CGT的指南的最终定稿,强化了我们的这一承诺,这是我们《药物竞争行动计划》的关键部分。”
相关要点
该指南于2019年2月首次作为草案发布。指南定稿提供了有关FDA可能采取的措施,对于具有CGT资格的药物,如何加快开发和审查其新药申请(ANDA)。指南定稿也解释FDA如何执行法定条款,对于有资格获得CGT指定并获得批准的新药申请(ANDA)药物,使其可以在市场上获得为期180天的独家经营权。
与草案版本相比,指南定稿明确规定,申请人应为每个单独的申请要求CGT资格。FDA写道:“ FDA不会将CGT资格自动适用于药物申请,因此需要申请人在每个相关申请中说明,以要求使用CGT途径。”
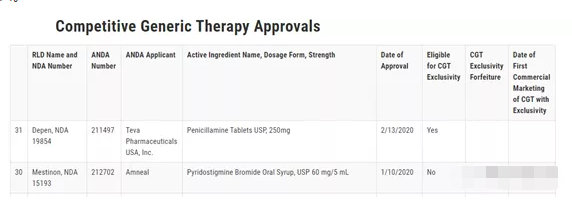
FDA最近发布了一个新网页,列出了所有通过CGT途径批准的ANDA仿制药。该列表每两周更新一次。
文章来源:蒲公英制药论坛
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。