扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 迄今中国细胞治疗的法规与日本比较接近,都是双轨制,也有些区别。日本医院和诊的ASRM临床试验可以在证明安全和有效性后,直接申请条件性限制性准入许可;这个在中国还没有这样的机制,但是根据目前行业内的做法,如果验证性临床(IIT)能完全按照临床试验的要求来做,经得起核查,应该有可能减免I期临床。
迄今中国细胞治疗的法规与日本比较接近,都是双轨制,也有些区别。日本医院和诊的ASRM临床试验可以在证明安全和有效性后,直接申请条件性限制性准入许可;这个在中国还没有这样的机制,但是根据目前行业内的做法,如果验证性临床(IIT)能完全按照临床试验的要求来做,经得起核查,应该有可能减免I期临床。
预计中国的法规会继续存在双轨制,而IND和BLA申报方面也会学习FDA/EMA的管理要求,细胞疗法的新药申报朝着欧美更严格的医药法规要求去倾斜。
转眼之间,FDA已有3个CART产品上市了,是我们学习的标杆。对比之下,FDA有更系统的指南,国内的文件也在陆续成熟和完善中。
药学部分中国和FDA的法规分别有:
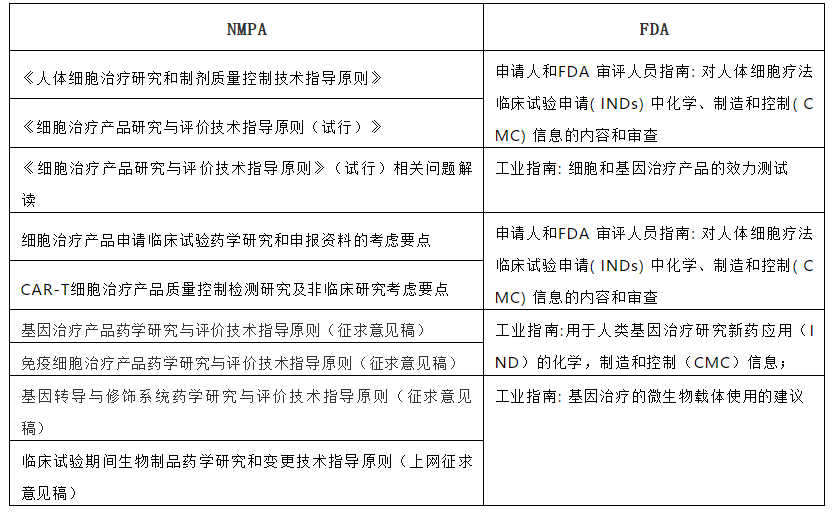
临床前部分中国和FDA的法规分别有:

临床部分中国和FDA的法规分别有:
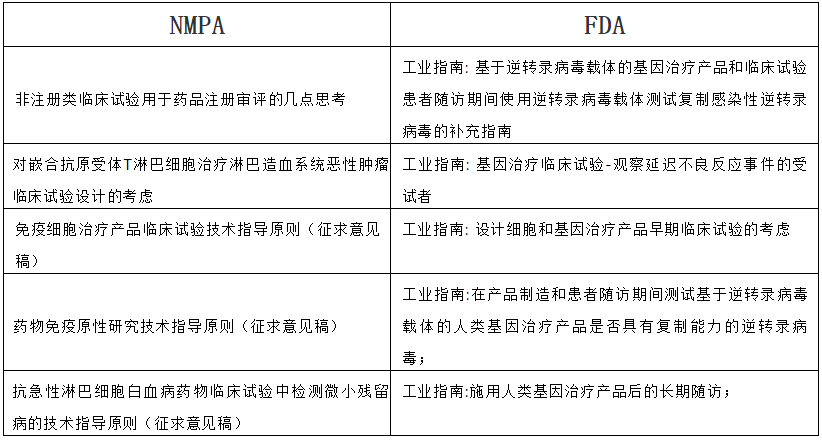
由以上对比可以看出,NMPA和FDA都很关注CMC部分和临床部分,而相比FDA,NMPA会更关注临床前动物试验部分。也有人跟我聊到,NMPA和FDA在具体每一部分的法规上的细节差异,根据经验简单而言,IND的方法学研究和临床前动物试验这一块的要求NMPA是更严格的,而更深入去钻研和对比,还要花点时间才能总结出来,继续努力!!!
另外,FDA还会针对各种细胞疗法有相应的指导原则,譬如同种异体胰岛细胞产品、治疗性蛋白质、视网膜疾病、罕见病、血友病等等。
我们在研究各种产品的时候,可以借鉴各国的做法,同时我们药监局肯定会陆续出台更多更细致的指导原则来指导我们的研发和临床。
文章来源:药启程
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。