扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 美国药典(USP)已通过提议新的通则章节提出有关如何检测原料药(API)和制剂中的亚硝胺杂质。章节概述了制药商可以用来证明其产品不含不安全水平的潜在亚硝胺杂质的一系列分析方法。
美国药典(USP)已通过提议新的通则章节提出有关如何检测原料药(API)和制剂中的亚硝胺杂质。章节概述了制药商可以用来证明其产品不含不安全水平的潜在亚硝胺杂质的一系列分析方法。
USP 亚硝胺通则章节<1469>于 9 月 1 日和 FDA 亚硝胺指南同一天发布,与 FDA 指南的一致之处在于,针对亚硝胺杂质的清单相似,并都主张采用基于风险的方法进行评估。USP 章节还遵循了 FDA 为亚硝胺杂质设定的每日可接受摄入量限度。【FDA 发布人用药中亚硝胺杂质的控制指南 2020/09/02】
USP 高级科学官 Jaap Venema 和化学药品高级主管 Edwin Gump 介绍了拟议新通则章节的某些要素。Venema 表示,当在血管紧张素 II 受体阻滞剂中发现亚硝胺,后来又在其它种类的药物中发现了亚硝胺时,USP 迅速加大努力以解决危机。2020 年 7 月,USP 启动了一项广泛的计划,旨在为制药企业提供更多指导,预防与亚硝胺有关的供应链漏洞。USP 推出了六个新的参照标准品,以支持制药商和监管机构分析和监测供应链中潜在有害的 N-亚硝基二甲胺(NDMA)以及其它亚硝胺。【FDA 发论文为亚硝胺检测方法辩护,USP 推出检测亚硝胺的新标准品 2020/07/28】
Gump 表示,章节的优点之一是与 FDA 指南基本一致。两者关于应研究的亚硝胺杂质清单几乎相同。USP 章节确定的应在药品中检测的六种亚硝胺包括:NDMA、N-亚硝基二乙胺(NDEA)、N-亚硝基二异丙胺(NDIPA)、亚硝基乙基异丙胺(NEIPA)、N-亚硝基二丁胺(NDBA)和亚硝基甲基氨基丁酸(NMBA)。USP 清单与 FDA 清单的不同之处在于 FDA 清单中的化合物 N-亚硝基甲基苯胺(NMPA)不在 USP 清单中。Gump 表示,“我很高兴,USP 章节与 FDA 指南之间没有任何可能给行业带来麻烦的重大出入。”
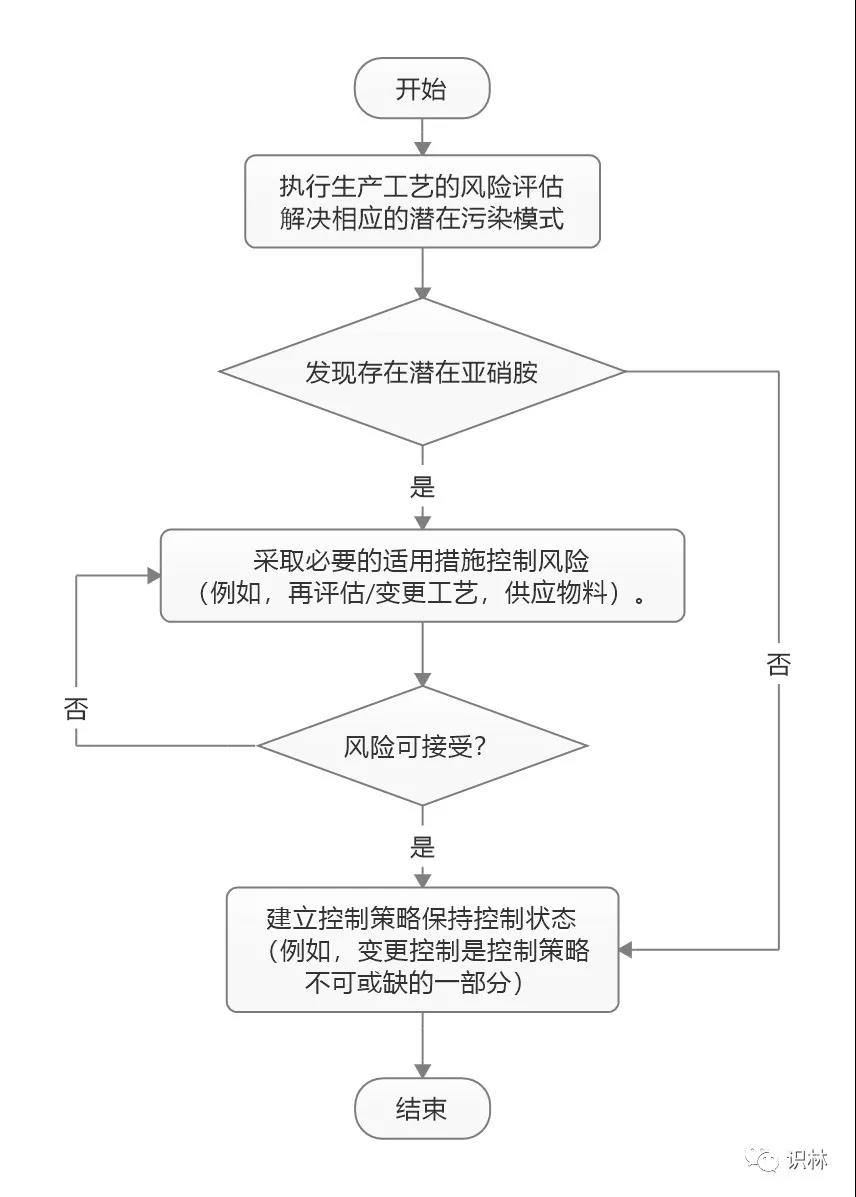
USP 章节与 FDA 指南都要求对潜在的亚硝胺进行风险评估。且与 FDA 一样,USP 指出,在风险评估中应考虑引入亚硝胺的所有潜在来源,包括 API、辅料、水、溶剂、生产工艺和包装成分。USP 章节中还给出了一个关于开发亚硝胺杂质控制策略的决策流程图(见下图),以帮助制药商建立所需的控制水平。
USP 章节还遵循 FDA 指南,确保药物的亚硝胺杂质每日摄入量不超过可接受的限值。FDA 规定 NDMA 和 NMBA 每日限度为 96 ng,NDEA、NMPA、NIPEA 和 NDIPA 每日限度为 26.5 ng。USP 章节避免设置可接受的每日摄入量限度。Gump 表示,“我们要小心的一件事就是不要在指南中规定可能与 FDA 不一致的规定性限度。”
因为有前车之鉴,早期实施 ICH Q3D 元素杂质的主要绊脚石之一就是 USP第<232>章和 ICH 之间不同的杂质阈值。Gump 表示,此次 USP 章节中未包含规定的限度信息,而是帮助制药商“了解可接受的每日摄入量,并根据最大每日剂量换算成药物的浓度阈值。”
USP 章节提出了四种分析方法,制药商可以使用这些方法来鉴别其产品中是否可能存在亚硝胺。
第一种方法是高效液相色谱-高分辨率质谱(HPLC-HRMS)方法,推荐用于检测 NDMA、NDEA、NDIPA、NEIPA、NMBA 和 NDBA。
第二种方法是气相色谱-质谱(GC-MS),推荐用于检测 NDMA、NDEA、NDIPA 和 NEIPA。
第三种方法是 HPLC-串联质谱,推荐用于 NDMA、NDEA、NDIPA、NEIPA、NMBA 和 NDBA。
第四种方法是 GC-串联质谱,推荐用于 NDMA、NDEA、NDIPA、NEIPA 和 NDMA。
Gump 表示,章节还为制药商提供了使用他们自己的分析方法的余地,以便可以适合其预期目的。
Gump 还强调了使用正确的分析检测方法的重要性,并表明方法应适合预期目的。2019 年 9 月,在线药房 Valisure 提交了一份公民请愿,要求召回雷尼替丁产品,因为药品中 NDMA 杂质含量很高。随后 FDA 的检测也发现 NDMA 但含量低于 Valisure 的检测,FDA 将差异归因于 Valisure 的 GC-MS 检测方法温度较高。【FDA 质疑第三方实验室对雷尼替丁中致癌物的检测方法 2019/10/03】 Gump 表示,雷尼替丁是“不稳定产品”,加热后会产生高水平的亚硝胺,因此,Valisure 使用的方法“可能不适用于该分子”,使用可以在中等环境温度下运行的色谱方法可能是更好的选择。虽然如此,但 FDA 经过进一步检测分析,于今年 4 月宣布要求制药商从市场上撤销全部雷尼替丁产品,原因之一就是产品中的 NDMA 会随着贮存温度的升高而增加。【FDA 要求所有雷尼替丁产品撤市,亚硝胺杂质可在正常贮存条件下增加 2020/04/02】
此外,对于二甲双胍中 NDMA 的检测 , FDA 与 Valisure 的检测结果也存在差异,FDA 还专门发表论文对检测方法进行分析。IPEM 教育项目教师组也点评了不同产品的 NDMA 检测方法可能出现的问题,并给出了解决建议 , 详见资讯:【FDA 发论文为亚硝胺检测方法辩护 , USP 推出检测亚硝胺的新标准品 2020/07/28】。
USP 将在 11 月 30 日之前接收对该通则章节的反馈意见,该拟议章节发布在药典论坛:https://online.usppf.com/usppf 。
文章来源:识林
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。