扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

近日,欧洲药典10.0发布,其中新增章节和修订的章节将于2020年1月1日生效,此外还有部分作了修正的章节,要求制药公司最迟不得迟于2019年8月31日作出变更!具体如下:
The 10th edition of the Ph. Eur.will be released in July 2019 and will be updated with eight supplements over the next 3 years (10.1 to 10.8). The new and revised Texts of the 10th Edition will become official on 1 January 2020.
欧洲药典第十版,将于2019年7月发布,并将在未来3年(10.1至10.8)更新8个增补本。第十版的新文本和修订文本将于2020年1月1日正式生效。
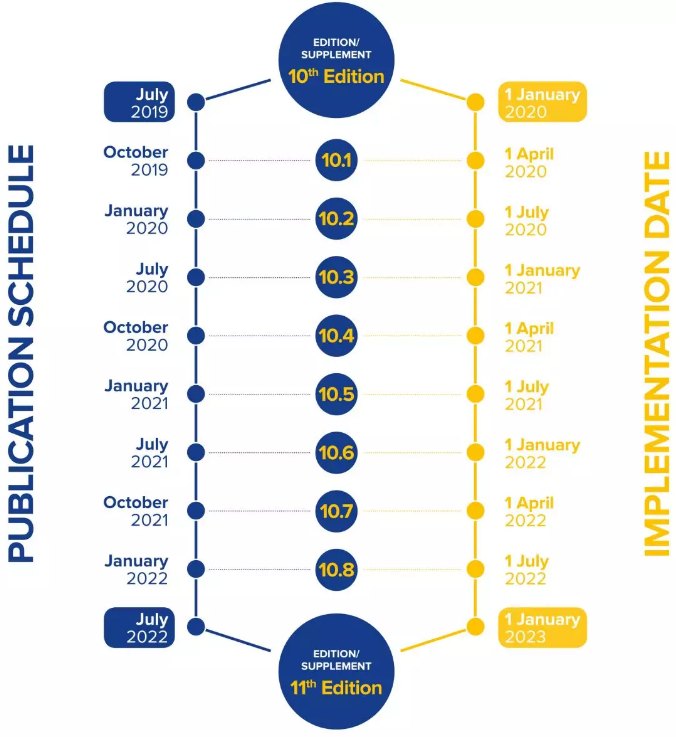
As of the 10th Edition of the Ph. Eur.,
欧洲药典10.0版内容:
文本的修改和/或更正已用竖线标出(印刷版)
划线表示文本已被删除(印刷版)
每篇文章的开头都有二维码,提供进一步信息的链接(如知识库)
对有关物质检测中计算百分含量的措辞进行了修改,明确了该物质的全称(包括反离子、水合物等),
需要使用五氧化二磷的测试,主要是干燥失重测试,已经进行了修改,以避免使用这种有毒物质,
修改气相色谱固定相的试剂的名称和描述,
术语‘Tamper-proof ’改为‘tamper-evident’,
通则第2.8.23《草药显微镜检查》:当使用非标准筛尺寸的粉末进行显微镜检查时,增加了参考文献
“粗”和“粗的”两词已从“粗粉”和“植物药粗粉”中删除(2.9.12筛分试验),
在2.8.16萃取物干燥残渣和2.8.17萃取物干燥损失的测试中,结果用百分数表示,而不是用百分数m/m表示。
新增内容:
新增以下章节,它们最迟将于2020年1月1日生效!
残留宿主细胞DNA的定量和定性
剪切细胞方法检查粉末流动特性
扫描电子显微镜
3.3. 用于人体血液和血液成分的容器及其制造中使用的材料;输血套及其生产物料;注射器
5.25. 过程分析技术

修订部分:
以下章节作了技术性的修订,它们最迟将于2020年1月1日生效!
2.2.25. 紫外可见吸收分光光度法
2.6.8. 热原
2.6.33.百日咳毒素残留
2.7.2. 抗生素微生物测定
2.7.23.造血产品中CD34/CD45+细胞的计数
2.7.35. 免疫比浊法测定疫苗成分
2.8.25. 中药和中药制剂的高效薄层色谱
2.9.1. Disintegration of tablets and capsules
片剂和胶囊的崩解
2.9.20. 颗粒污染:可见颗粒
3.1.13.塑料添加剂
3.3.1.人体血液和血液成分容器的材料
3.3.2.用于人体血液和血液成分容器的塑料聚合物(氯乙烯) 材料
3.3.3. 用于血液和血液成分输液器管材的塑料聚合物(氯乙烯) 材料
3.3.4.用于人体血液和血液成分的无菌塑料容器
3.3.5.用于人体血液和血液成分的塑料聚合物(氯乙烯)无菌空容器
3.3.6.用于人体血液(含有抗凝液)的塑料聚合物 (氯乙烯)无菌容器
3.3.7. 用于输送血液和血液成分的装置
3.3.8. 无菌一次性塑料注射器
4.试剂
5.3.生物含量结果的统计分析和检验
5.8. 药典协调
5.21. 应用于分析数据的化学测量方法
5.22. 中药用草药名称
5.24.化学成像


修正的部分
以下章节作了修正,并在其标题上标注了“10.0版修正”应尽快考虑这些修正,并最迟不得迟于2019年8月31日。
1. 凡例
2.2.5.相对密度
2.2.29. 液相色谱
2.2.31. 电泳法
2.4.23.脂肪油中的甾醇
2.4.25.环氧乙烷和二恶英
2.4.26. NN-二甲基苯胺
2.4.32. 富含欧米伽-3酸的油中的总胆固醇
2.5.19. 多糖疫苗中的O-乙酰
2.5.37.甲磺酸中的甲基、乙基和亚丙基磺酸
2.5.38.活性物质中的甲基、乙基和甲磺酸异丙酯
2.5.39.甲磺酸中的甲基酰氯
2.5.40.活性物质中的甲基、乙基和甲苯磺酸异丙酯
2.5.41.活性物质中的甲基、乙基和异丙基苯磺酸盐
2.7.8.破伤风疫苗的测定(吸附)
2.8.9. 精油蒸发残渣
2.9.10. 乙醇含量
2.9.11. 甲醇和2丙醇的检验
3.1.14.用于静脉输液容器的塑料聚合物(氯乙烯)材料
3.2. 容器
5.1.2. 用于无菌产品生产的生物指示剂及相关微生物制品
5.1.6. 微生物质量控制的替代方法
5.2.12.生产细胞和基因治疗药品的生物原料
5.9.多晶型
5.10. 药用物质的杂质控制
5.12. 标准品
5.15. 辅料的功能相关特性
5.16.结晶性






此外,还有一部分修改了标题和编号。
文章来源:允咨GMP制药技术培训
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。