扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

方法转移程序是在两个实验室之间进行,通过比较转出方和接收方实验室的分析结果,以确认分析方法在接收方实验室条件下的适用性。
1.什么情况下进行方法转移
方法转移通常用于验证过的自建分析方法。法定方法在不同实验室应用时通常执行方法确认。方法转移包含文件转移和接受能力转移。当验证过的方法在实验室间转移时,接收实验室应证明其能够成功执行方法。典型的方法转移情况有:
• 从研发实验室转到质控实验室
• 实验室搬迁后从A场所转移到B场所
• 从开发实验室转到合同实验室
• 购买产品后从A公司转到B公司。
2.转移前实验室的准备工作
转出实验室通常是方法开发和验证部门,转出实验室应负责提供分析方法转移文件包,包括方法操作规程,对照品和样品信息、方法验证文件和数据、必要的支持文件等信息。
方法转移前转出实验室应对接收实验室进行培训,包括转移方法的操作细节、方法开发、验证过程和结果以及遇到的问题等。
转出实验室应根据方法测试需求对接收方实验室进行软件和硬件的符合性进行检查,以确定接收方是否具备执行方法转移的资源和测试条件。包括仪器设备状态,实验物料和耗材、文件和程序、人员、实验室环境及方法准备等。
方法转移的日程和可接受标准应由双方共同确定。确定接收实验室具备该方法检测需要的测试环境和资源时才能执行方法转移活动。
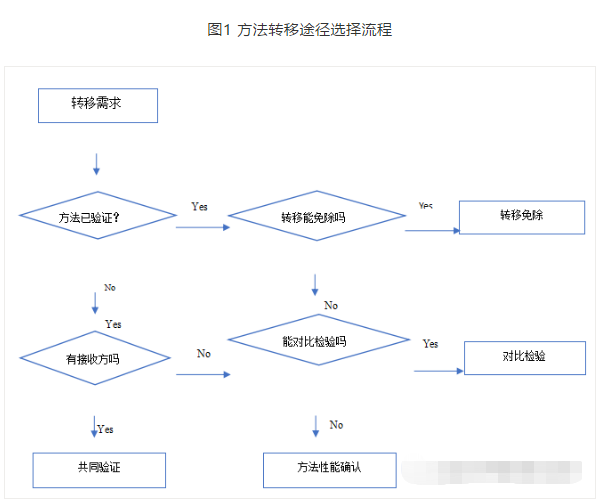
3.分析方法转移途径
分析方法转移的方式包括对比检验、共同验证、部分全部或部分验证以及转移豁免。在不同的阶段采用不同的转移方式。
1) 对比试验
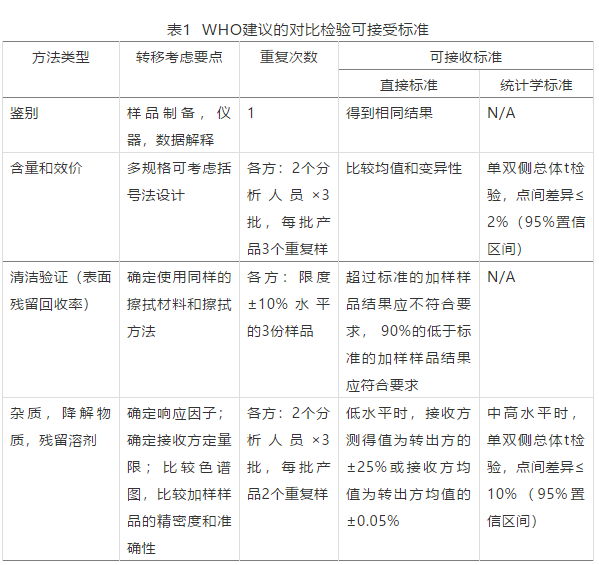
对比检验是分析方法转移最常用的方式,需要转出和接收实验室同时对同批次的样品进行检验(需要检验的批次数应预先规定)。检验结果均应符合质量标准规定,同时通过统计工具比较转出和接收实验室的所得结果的接近程度。对比检验的建议和可接受标准建议见下表(可接受标准需根据测试方法类型和实际生产规模进行适当调整)。
2) 共同验证
如果有方法接收方,在被转移的方法未进行正式验证前,可执行两个实验室或两个场所的共同验证,接收方实验室作为验证小组的成员参与方法验证工作。
3) 全部或部分验证
对于复杂的方法,接收实验室需要重复部分或所有验证测试项目。验证项目的选择和验证的程度应通过风险评估确定。全部验证的参数选择遵循方法验证和确认管理规程规定。
4) 转移豁免
某些特定的情况下可不进行常规的分析方法转移。方法转移豁免应经过双方的风险评估确定转移豁免不影响方法在接收方的正确应用。转移豁免的适用情况包括:
新产品的成分与已有品种的成分类似及活性药物的浓度与已有产品的浓度类似,并且接收实验室对检验方法有使用经验和使用数据;
转移的方法与接收方已使用的有经验的方法相同或近似;
负责方法开发、验证或产品日常检验人员由转出实验室加入接收实验室。
转移的方法为药典方法并且未作任何修改,此时执行方法确认。
分析方法转移途径选择示意图如下:
分析方法验证系列:第十三节 分析方法生命周期内持续符合性确认概述
分析方法被成功验证和实施后,在其产品的生命周期中应遵守该方法的操作程序,则分析方法在日常使用中应进行性能监测和趋势分析,以持续保证方法在使用的生命周期内持续符合其既定用途。FDA和WHO对于分析方法生命周期内的持续符合性均进行了规定。
1.分析方法的质量监控和回顾
FDA和WHO在分析方法验证指南中规定应定期对方法表现进行趋势分析,评估是否需要对分析方法进行优化,或对全面或部分分析方法进行再验证。
在方法使用周期中对于关键参数的定期测试将会对方法性能实现监控。该阶段持续收集和分析有关分析方法性能的数据。监控可包括
方法性能监控测试数据趋势分析
标准品或控制样数据趋势分析
日常检测数据的趋势分析
SST数据趋势分析
稳定性趋势分析
失效数据,如OOS/OOT和SST失效数据
其它合适数据
方法监测测试项目的选择取决于方法的类型和测试需求,如杂质定量测试方法建议的监控项目包括空白、准确度、精密度和LOD&LOQ。监测的频次应经过评估确定,监控的可接受标准应与参照方法验证的可接受标准。
如果监控结果显示方法不受控应启动调查,并采取相应的CAPAs。
如果一个分析方法只能通过不断调整分析方法里规定的运行参数来符合所建立的系统适用性要求,则应对该分析方法进行再评估、再验证,适当时进行修正。
定期的评价方法在生命周期中是否仍处于受控状态首先可以确定方法是否符合要求,并可以减少不必要的再验证。评价分为周期性评价及变更引起的评价。
评价的周期通常为6个月或者12个月。
一些变更可能引起对方法的评价,如
超趋势结果
方法质量回顾结果
产品年度质量回顾结果
重大工艺变化
新仪器引入
其它
根据评价的结果,应采取必要的措施保证方法始终处于受控状态。可能的行动措施包括:方法性能检测、方法再验证、培训、调查及相应的CAPA。
2.分析方法变更
如果基于风险的评估或其它原因导致对分析方法进行变更(例如对设备有变更、试剂的变更,方法参数变更),或采取新的方法取代旧的方法,或分析方法转移至一个新的检测场所,则要考虑进行再验证。
工艺变更时可能也需要对分析方法进行再验证,例如可能影响分析方法性能的原料药生产工艺变更(例如合成路线、发酵)或引入新的制剂配方。
如果是分析方法本身的变更,需要确认分析方法在设计空间外的变更对方法性能特性无不良影响,通过风险评估来确定需要进行的再验证的工作,以保证满足ATP要求。
可能的确认范围从评估方法变更后的操作能持续满足系统适用性要求,至进行对比研究以证明变更对方法无不良影响。方法使用者要进行再验证以保证分析方法维持其关键性能指标(例如专属性、精密度、准确性)。
总而言之,再验证的程度取决于变更的性质和影响。
3.分析方法生命周期内的持续提升
在一个产品的整个生命周期中,新的资料和风险评估(例如对产品CQA有更好的了解,或发现新的杂质)可能会启动一个新的或替代的分析方法的研发和验证。
新的技术可能会带来产品质量保证方面更多的了解和/或可信度,使用者者应定期评估产品分析方法的适当性,考虑方法的优化或者新的或可替代的方法。
文章来源:允咨GMP制药技术
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。