扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 上周,FDA公布了其在美国国会听证会上的证词,就FDA的海外药品生产检查程序,进行了阐述。演讲人是FDA的高级官员,包括法规事务副局长、全球政策和战略副局长和CDER监管计划副主任。
上周,FDA公布了其在美国国会听证会上的证词,就FDA的海外药品生产检查程序,进行了阐述。演讲人是FDA的高级官员,包括法规事务副局长、全球政策和战略副局长和CDER监管计划副主任。
以下是要点节选:
制药生产业的全球化
在过去的30年中,制药业已成为一个日益全球化的企业。从1970年代开始,工业从美国本土转移到了波多黎各,以响应税收优惠政策,然后转移到了欧洲和当时正在发展的国家,例如中国和印度。
发展中国家由于其较低的劳动力,能源和运输成本,可以为制药公司节省大量成本。此外,与发达国家相比,它们的环境法规通常较弱。世界银行的一项研究估计,2004年,与美国和欧洲相比,中国和印度拥有约40%的成本优势。
FDA在2011年的报告《通往全球产品安全和质量的途径》中还指出,中国和印度都享有人工成本优势,在印度生产活性药物成分(API)可以使美国和欧洲公司的成本,降低约30%-40%。
随着美国药品市场转向低价仿制药,生产商承受着越来越大的成本压力,并发现这些效率迫切需要将更多的设施设在海外的原因,特别是在世界发展中地区。这种转变反映在药物评估和研究中心(CDER)的场所目录(“目录”)中,该目录列出了全球所有需接受FDA常规检查的药品生产设施。
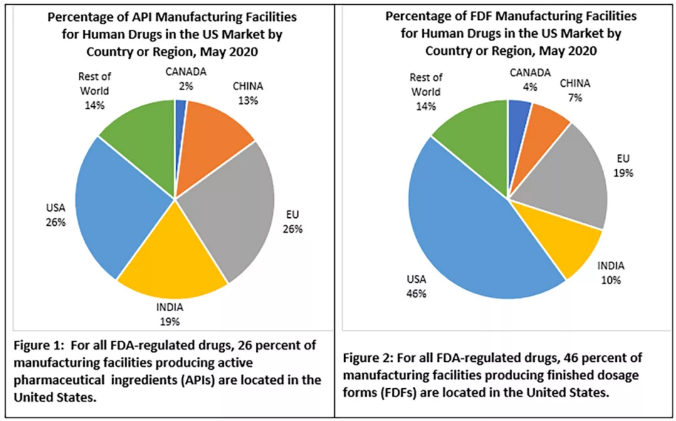
截至2020年5月,美国本土有26%的生产原料药的工厂,和46%的生产人用药物最终制剂(FDF)的工厂位于美国 (见下图)。
在2000年代,这一运动加速了,但是由于每两年进行一次国内检查的法定要求和有限的人员配备,FDA的检查局仍然专注于国内生产。
在2012年通过《食品药品管理局安全与创新法》(FDASIA)之前,法律要求FDA每两年对美国的生产设施进行一次检查,但对海外设施的检查频率没有类似的授权。这导致对国内设施的检查很频繁。
FDA药品检查计划的全球化
为了应对从国内生产向全球生产的转变,以及FDASIA的通过,FDA制定并实施了一项全面战略,以促进医疗产品的更好协调和监督。除了增加海外检查,我们的努力还包括:
开发新的执法和监管工具
加强与海外监管机构和其他利益相关者的合作
制定国际统一的标准和标准趋同
向海外行业介绍FDA要求,以及
提高供应链的透明度和问责制
在中国,印度,欧洲和拉丁美洲建立海外办事处,并在海外设有分支机构。
FDA的药物检查计划从2000年初期的重点主要放在美国的设施,转变为一项计划,该计划自2015年以来在海外进行的检查超过了在国内进行的药物检查。请参见下图:
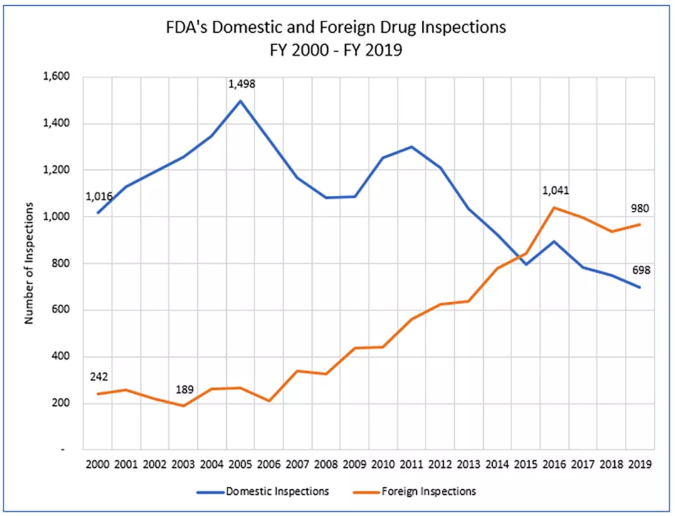
图:2006年之后FDA对海外药品生产设施的检查急剧增加,自2015年以来超过了对国内药品设施的检查
FDA的药品检查计划现在基于风险。FDA根据确定的特定标准,优先考虑被认为具有较高风险的检查设施。
当FDA确定需要进行突击检查时,FDA便进行了此类操作。在过去的几年中,FDA研究人员对包括印度和中国在内的海外生产工厂进行了未经通知的检查。
当在海外生产工厂发现重大问题时,FDA会使用其他工具来保护患者,包括将工厂置于进口预警状态,以防止潜在违规产品进入美国市场。
检查场所选择模型
为了满足优先使用有限资源的需求,FDA在2005年对药品设施监督检查实施了基于风险的方法。一种数学模型,即选址模型(SSM),旨在选择那些不符合既定生产质量标准的,具有最大公共卫生风险的设施。FDA使用模型的结果,来准备要检查的设施的优先列表。
有了新资源,FDA就能够检查以前未检查过的某些设施。目录显示,截至2016年12月,有963家从未经过FDA检查的海外生产工厂,而这些工厂现在都已经进行相应的安排。到2019财年末:
FDA已检查了496家,约占这些先前未检查过的设施的52%(见下图);
从目录中删除了另外361个设施(占37%),因为它们由于多种原因不再成为FDA检查义务的一部分,例如,它们已经停业,未在美国市场服务,或已在美国错误注册;
此外,有52%或5%的设施拒绝检查;
FDA调查人员无法使用设施中的34个,即百分之四,因为他们无法前往(例如,由于旅行警告);
还有20个(即百分之二)没有进口到美国的药品
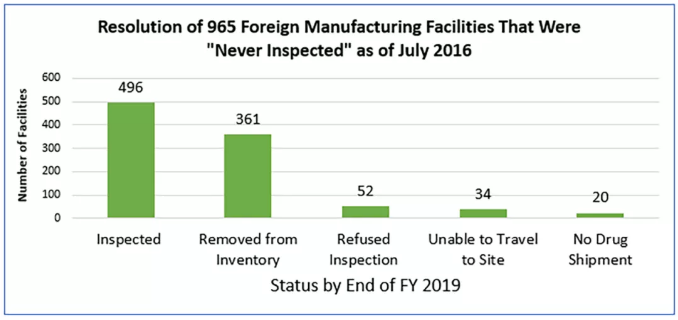
图. FDA现在已经评估了所有以前“从未检查过”的设施
检查结果
在对生产设施进行检查之后,FDA将检查分为“未指示任何行动”(NAI),“自愿采取行动”(VAI)或“指示官方行动”(OAI)。
未指示任何行动(NAI):表示在检查过程中未发现令人反感的条件或做法(例如质量问题)(或为次要问题,不足以采取进一步的管制措施)。
表明的自愿行动(VAI):是指发现了令人反感的条件或做法,但FDA不准备采取或建议采取任何行政或监管措施。
指示官方行动(OAI):意味着将建议采取监管和/或行政措施。
毫不奇怪,自2012年以来,针对高风险设施的检查更加频繁,FDA发现了更多的缺陷,特别是在FDASIA和GDUFA成立之前,没有像国内工厂那样,经常进行检查的海外工厂。
值得注意的是,这些检查通常是事先通知设施的海外检查(预先宣布)。检查结果显示,除印度外,所有国家或地区的检查最终结果(NAI或VAI)为90%或更高,这是可以接受的(见下图)。
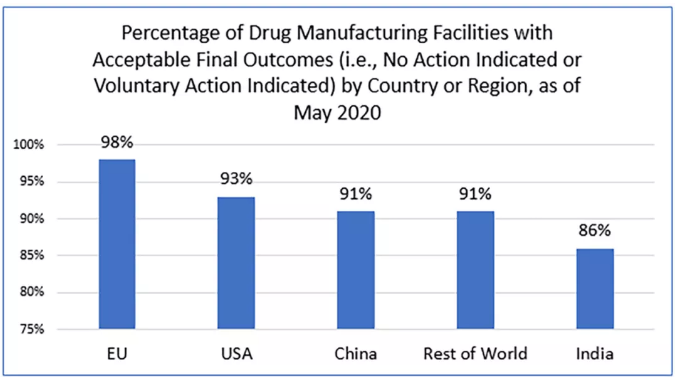
图.生产人用药品的生产工厂的大多数最终检查结果是可以接受的,这意味着它们被归类为“未采取行动”或“未采取自愿行动”。但是,印度的可接受结果百分比低于其他国家和地区。(这些是截至2020年5月的结果,用于FDA目录中设施的最新检查。)
FDA鼓励工业界采用先进制造技术
除了质量管理的成熟度外,FDA还鼓励制药商投资于先进的生产技术,以改善其产品和工艺。尽管在汽车,航空航天和半导体等其他行业中广泛使用了先进技术,但制药公司现在才开始使用先进的生产技术。
新技术包括“连续生产”(CM),其中成品药、或活性药物成分,以连续流的形式生产,这与传统的批量生产不同,在传统的批量生产中,不同加工步骤之间存在中断或停止。在先进药物生产的一些实例中,可以从活性成分的化学合成到片剂或其他剂型的生产来连续生产。产品质量可以通过现代化的自动化和控制系统精确控制,并且可以在生产过程中使用高度灵敏的分析工具进行密切监控。
先进制造的其他示例包括3D打印,隔离技术,小型化和机器人技术。
文章来源:蒲公英
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。