扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 一、实验室无效检验数据可能包括:
一、实验室无效检验数据可能包括:
a.产品(包括中间产品)放行
b.物料(原辅料和包装材料)放行
c.生产过程控制数据(如IPC)
d.稳定性考察、公用工程放行和监测(如HVAC)
e.验证和确认数据(如PV/CV/关键设备确认)
f.实验室仪器和设备校准数据
g.其它。
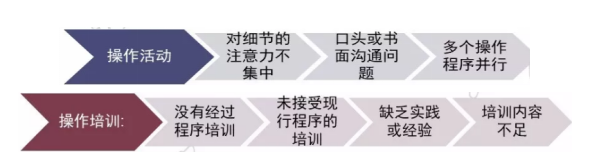
二、实验室无效数据来源主要是以下2方面:
三、实验室无效数据的调查和管理流程如下:
1、OOS/OOT/OOE调查流程
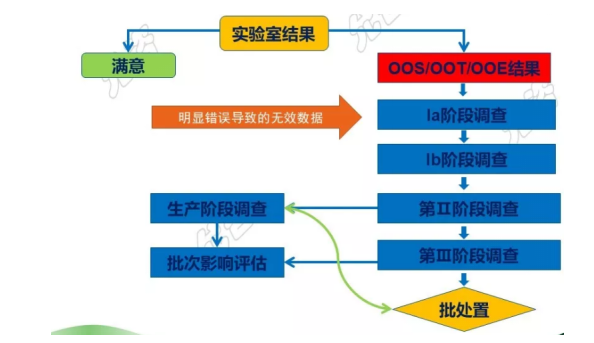
注:FDA在其质量量度质量修订草案中阐述了无效的OOS率量度。无效的OOS率的定义为:报告期内,批次放行检验和长期稳定性检验的OOS结果中,因检验过程中的过失而被判定无效的OOS结果,除以批次放行和长期稳定性检验的全部OOS结果。
作为衡量实验室操作的稳定可靠性的指标,无效的OOS率越高,意味着实验室操作的稳定性越差。
2、 无效检验数据管理的关键点是:
a.无效数据的确定必须经过适当的科学的调查:
b.无效数据的受控和可追溯
c.无效数据反映实验室操作的稳定性和可靠性
OOS/ OOT调查管理及实验室数据完整性一直是国内外 cGMP检查的关注点及高频出现缺陷, 虽然国内外的GMP条款及相关指南对于这些领域提出了要求和通用做法,但缺乏针对实验室的细则,造成了制药企业在执行层面上的理解不同和符合性检查失败。
文章来源:允咨GMP制药技术
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。