扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 制药企业年底都会有一项至关重要的任务,也就是着手做产品年度质量回顾这项工作,这是一个总结今年工作,并根据今年表现制定明年计划的过程。由于很多公司生产的产品类型之复杂,数量之多,导致质量回顾变成一项非常浩大工程。甚至会存在有些公司一年过去一半了才将将完成上一年的年度质量回顾。
制药企业年底都会有一项至关重要的任务,也就是着手做产品年度质量回顾这项工作,这是一个总结今年工作,并根据今年表现制定明年计划的过程。由于很多公司生产的产品类型之复杂,数量之多,导致质量回顾变成一项非常浩大工程。甚至会存在有些公司一年过去一半了才将将完成上一年的年度质量回顾。
⭐什么是年度质量回顾?
先从字面意思可以解读为:对该公司一年度生产的所有产品的各种质量参数的回顾。欧盟称之为PQR(product quality rewiew),FDA称之为APR(annual product review),WHO发布的GMP中称之为APQR(annual product quality review),其实都是同一个东西,也就是我们所说的年度质量回顾,各国法规可能会对年度质量回顾的内容要求有所不同,但基本框架是一致的。
2004年欧盟GMP中对产品年度质量回顾首次提出要求,现行版欧盟GMP中规定“应对所有获得批准的药品, 包括那些仅供出口的药品, 进行定期或滚动式的质量回顾以证明所用工艺的始终一致性,起始原料和成品现行质量标准的适当性,并重点反映出变化趋势以及产品和工艺的改进。产品质量回顾一般情况下每年进行一次,并形成文件”。
中国2010版GMP中规定:“应当按照操作规程,每年对所有生产的药品按品种进行产品质量回顾分析,以确认工艺稳定可靠,以及原辅料、成品现行质量标准的适用性,及时发现不良趋势,确定产品及工艺改进的方向。应当考虑以往回顾分析的历史数据,还应当对产品质量回顾分析的有效性进行自检。”“应当对回顾分析的结果进行评估,提出是否需要采取纠正和预防措施或进行再确认或再验证的评估意见及理由,并及时、有效地完成整改。”
首先年度质量回顾不是可选项,而是必选项!无论是中国、欧盟还是FDA,法规都要求每年进行一次全面的产品质量回顾。质量回顾不是单纯对各种信息数据的收集汇总,重要的是对数据趋势的分析评估。
⭐为什么要做年度质量回顾?
确认在目前工艺条件下能够生产出符合相应质量规定的产品。
通过产品数据的趋势分析,对产品做出正确评价,获得最新的产品质量信息,利于产品的持续改进。
使药品监督部门掌握制药企业的质量动态以及管理效果,提高监管效率。
总而言之,最终目的是能够持续改进产品质量,同时不断提高公司质量体系。因此,年度质量回顾也成为了一个有效的质量改善工具。
⭐产品年度质量回顾包括哪些内容?
欧盟GMP和中国GMP两者回顾的很大一部分内容是一致的,主要包括概述、所有商业批生产批次,原辅料包材的关键质量参数和供应商管理,检验数据,稳定性数据,变更偏差管理,产品投诉/召回/退货情况,相关设施设备的验证等。详见下表:
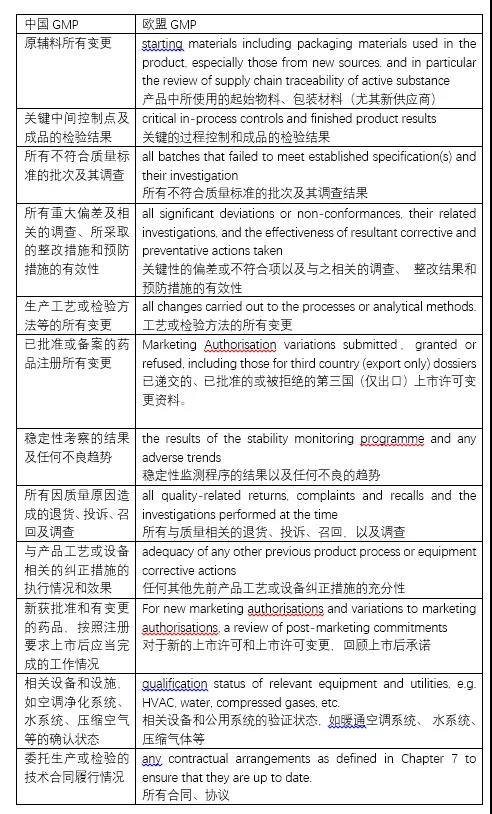
⭐如何开展产品年度质量回顾工作?
做产品年度质量回顾的工作量非常大,不仅仅是靠1个部门能够做好,通常是由QA部门统筹,各职能部门如生产部、工程部、QC等的配合共同完成。QA部门会建立企业年度产品质量回顾流程,并对相关人员进行培训。每年制定年度产品质量计划,按计划任务分配到相应各职能部门,并规定完成时限。各部门按要求收集汇总产品相关数据,利用各种统计分析方法对数据趋势进行分析,制定合理有效的措施,QA汇总分析所有数据,并对年度
质量状态进行总结形成汇总报告,并有相关人员审批等。最终将质量回顾情况以书面形式报告到当地药品监督管理部门。一般年度质量报告应在回顾周期后3个月内完成。
文章来源:法默康GMP咨询
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。