扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 清洁验证主计划
清洁验证主计划
所有验证活动应有计划,清洁验证计划的要求应在主计划或类似文件中规定和记录,药品生产清洁验证主计划的内容原则上可能是相同。计划应描述职责、清洁验证计划和清洁验证的实施情况。最好有一个详细的清洁验证主计划,该计划在整个厂区验证主计划中有所描述,清洁验证主计划可能包含所有内容。还有一种方法是准备一个概述版的清洁验证主计划,再准备一个清洁验证执行或项目计划,详细说明清洁验证的要求。应当定期审核和更新这些实际存在的文件,定期编写计划报告,总结计划执行过程中的重要活动。
计划应说明清洁验证程序的每个重要方面,主计划的构成及所需提供的适当细节取决于特定设施的实际操作,主计划的构成包括但不限于以下主题。
1.1 目的
清洁验证主计划有助于公司管理层了解验证活动所涉及时间、人员的安排,以及进行相关确认与验证活动的必要性,有助于验证团队成员了解各自的职责,此外让参与这个项目的人员以及检查人员能够从全局了解该工厂所使用的验证方法和所有的验证活动。
1.2 范围
清洁验证主计划包括验证的一般原则,可接受标准计算,分组(矩阵)和最差条件产品评估等方面的规定。
1.3 职责规定
对验证过程中各部门的职责进行详细规定与描述。
1.4 产品与设备分组(矩阵)和最差条件产品评估
通常情况下一条生产线会同时生产多个品种,每个品种由活性成分和辅料组成,在清洁验证中不必为所有残留物制定限度标准并一一检测,因为这是不切实际且没有必要的。在一定意义上,清洁的过程是个溶解的过程,因此通常的做法是从各组分中确定最难清洁的物质,作为目标化合物即验证对象,目标化合物一般要考虑其特性,如:
溶解性风险
毒性、药理
难于清洗,如对设备表面材质有一定附着力
配方中包含难以清洗的油脂、色料或矫味剂的产品(颜色、香味与味道)
生产量高的品种(生产频率高的产品相应的清洗频率高)
清洗过程如果使用清洗剂,则其残留物也应视为标记物
同一工序使用到的设备可能会有很多种,对于同一类型的设备,可以考虑对其分组并同时进行验证。对于设备分组,以形式和功能为标准定义分组原则,对设计和功能相似,大小不同的设备可以分为一组
1.5 残留限度的计算和可接受标准
化学残留可接受限度
清洁剂残留的确定
微生物水平的确定
如何确定残留物限度是一个相当复杂的问题,企业应当根据其生产设备和产品的实际情况,制定科学合理的,能实现并能通过适当的方法检验的限度标准。目前企业普遍接受的限度标准基于以下原则:以目检为依据的限度;化学残留可接受限度;微生物残留可接受限度。
1.5.1. 以目检为依据的限度
目检要求不得有可见残留物,在每次清洗完后都要求进行检查并对检查结果进行记录,此项检查应该作为清洁验证接受限度的第一个接受标准。
1.5.2. 化学残留可接受限度
计算化学残留可接受限度有两种方法,生物活性限度(最低日剂量的1/1000)和浓度限度(10ppm)。在考虑可接受残留限度时,综合考虑两种方法,选择最严格的标准作为清洁验证最终标准。
① 采用健康基础数据的可接受标准
在可以获得可接受日暴露水平(ADE)或允许日暴露量(PDE)值时,最大允许残留(MACO)应基于ADE计算。MACO计算的原则是基于ADE/PDE值,计算允许从上一个产品带入下一个产品中的残留量。
根据以下公司计算ADE值或PDE值,将结果用于MACO值的计算:
ADE=NOAEL×BW/(UFc×MF×PK)
根据以下公式从ADE值计算MACO值:
MACO=ADEprevious×MBSnext/TDDnext
ADE----可接受日暴露水平
MACO----允许最大残留:从上一产品带入下一产品的最大可接受量
BW----平均成人体重
UFc----组分不确定因子:反映单个变量之间、不同品种差异、亚急性折算为急性外推、最低可见损害作用水平到无可见损害作用水平的推断,数据完整性等补偿因素的综合系数
MF----修正因子:用于表达未被其它因子覆盖的不确定因素
MBSnext----下一产品的最小批量
TDDnext----下一产品的标准治疗日服用剂量
② 生物活性的可接受限度:最低日治疗剂量的1/1000
根据药物的生物学活性数据---最低日治疗剂量(MTDD)确定残留物的限度是制药企业普遍采用的的方法。一般取最低日治疗剂量1/1000为残留物限度,可以认为即使存在很大个体差异,该残留量也不会对人体产生药理反应。因此高活性、敏感性的药物宜使用本法确定残留物限度。
一般表面计算公式如下:
L1/1000=MTDa/1000×Nb/MDDb×Sb
MTDa----清洗前产品最小日给药剂量中的活性成分含量
Nb----清洗后产品的批量
MDDb----清洗后产品的最大日给药剂量的活性成分含量
Sb----清洗后产品活性成分含量的百分比(%,W/W)
③ 浓度限度:十万分之一(10ppm)
在下一个产品中的残留物数量级别应不超过十万分之一(10ppm),该限度依据分析方法客观能达到的能力而制定的,从控制微生物污染及热原污染角度上看,也比较安全。一般除非是高活性、高敏感性的药品,该限度的安全性是足够的。
从残留物浓度限度可以推导出设备内表面的单位面积残留物浓度(表面残留物限度),假设残留物均匀分布在设备内表面上,在下批生产时全部溶解在产品中。
设备下批产品的生产批量为B(kg),因残留物浓度最高为10×10-6即10mg/kg,则残留物总量最大为10B(mg);单位面积残留物的限度为残留物总量除以测量的与产品接触的内表面积,设设备总内表面积为SA(cm2),则表面残留物限度L=10B/SA(mg/cm2)。为确保安全,一般应除以安全因子F,则L=10B/(SA×F)( mg/cm2)
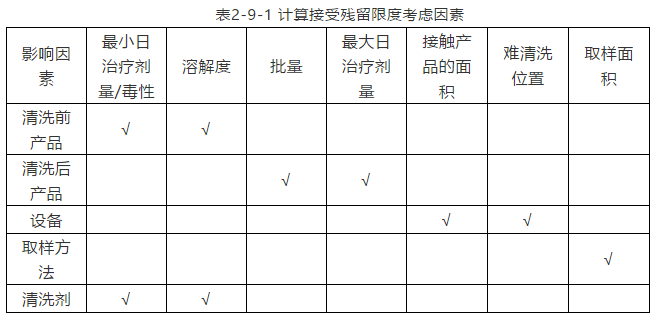
计算接受残留限度需考虑的要素如下表
1.5.3. 微生物限度
清洗的微生物验证可以和清洗的化学验证同步进行,微生物的特点是在一定环境条件下会迅速繁殖,数量急剧增加。而且空气中存在的微生物能通过各种途径污染已清洁的设备。设备清洗后存放的时间越长,被微生物污染的几率越大。因此,企业应综合考虑其生产实际情况和需求,自行制定微生物污染水平控制的限度及清洗后到下次生产的最长贮存期限。1.5.4. 残留溶剂的限度标准
药品生产和清洁中可能用到除水外的有机溶剂,ICH在《残留溶剂指南》中将溶剂分为3个级别。⑴ 一类溶剂
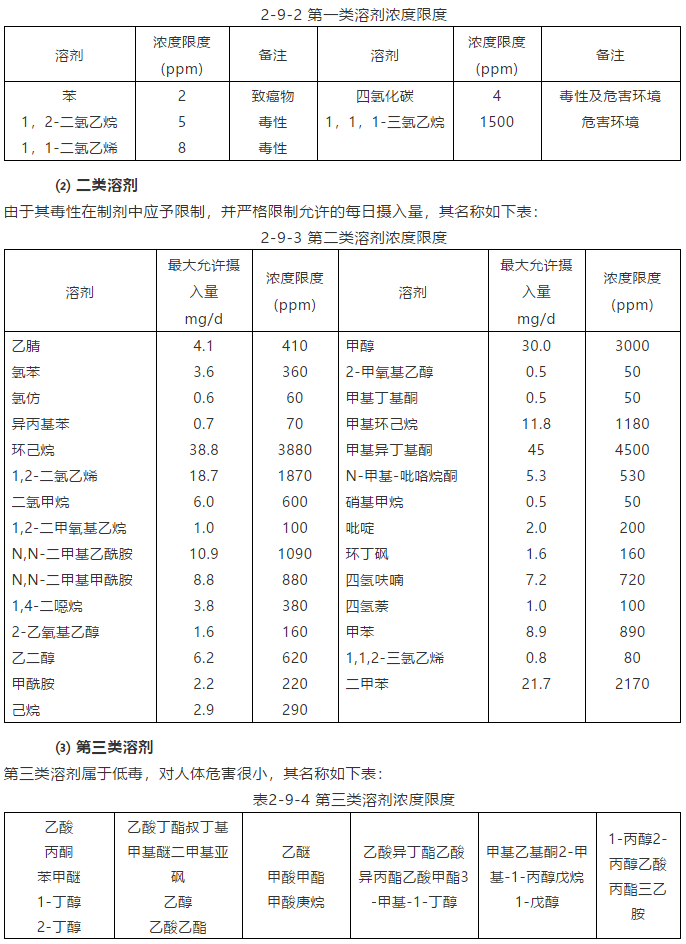
因其具有不可接受的毒性或对环境造成公害,第一类溶剂在制药生产中不应该使用,如必须使用时按下表对残留进行控制,其名称如下表:
ICH《残留溶剂指南》规定,一类、二类溶剂仅在不可替代的情况下用于药品生产,但不能用作清洁剂。在无法避免时,三类溶剂可作为清洁剂,其在下批生产中允许的溶剂残留浓度不应超过初始溶剂浓度的0.5%。
1.6 最难清洁部位和取样点
设备最难清洁部位一般是根据生产经验及风险评估进行确定,考虑到在线清洗无法覆盖的区域及手工清洗中无法拆卸的部件表面,另外对于设备中不同组成部分,使用到的不同材质,需要对其进行综合考虑,确认设备最难清洁部位。确定最难清洁部位首先可以作为设备设计时的参考,其次能进一步确认清洁验证中取样点,但这个过程仅适用于淋洗法取样的方式。
1.7 清洁验证取样方法确认
清洁难清证取样方法确认可以参见2.9.5.2节取样方法验证。
1.8 清洁验证主计划其他内容还包括不局限于以下内容
清洁验证时间计划表
清洁验证日常监测/维护要求
参考文件
附录
文章来源:允咨GMP制药技术
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。