扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们
 1. TL118
1. TL118
TL118由苏州韬略生物科技有限公司研发。2019年5月国家药品监督管理局(NMPA,原CFDA)受理本品的临床试验申请(化药1类)。2019年8月获得临床试验默示许可,拟用于NTRK基因融合实体瘤的治疗。
NTRK基因融合是由于染色体变异,导致NTRK基因家族成员(NTRK1、NTRK2、NTRK3)与另一个不相关的基因融合在一起。TRK融合蛋白将处于持续活跃状态,引发下游信号通路永久性级联反应,驱动肿瘤发生。NTRK基因融合可发生在身体任何部位,在多种成人和儿童的实体瘤中均有发现。
2. FL058FL058由齐鲁制药有限公司研发,2019年5月国家药品监督管理局(NMPA,原CFDA)受理本品的临床试验申请(化药1类)。2019年8月获得临床试验默示许可,拟用于复杂性腹腔感染(与甲硝唑联用)、复杂性尿路感染和医院获得性肺炎及呼吸机相关肺炎的治疗。
3. SAL092SAL092由深圳信立泰药业股份有限公司研发,2019年5月国家药品监督管理局(NMPA,原CFDA)受理本品的临床试验申请(化药1类)。2019年8月获得临床试验默示许可,用于治疗高胆固醇血症和混合型血脂异常。
4. ASC18ASC18由歌礼药业(浙江)有限公司研发,2019年5月,国家药品监督管理局(NMPA,原CFDA)受理本品的临床试验申请(化药1类)。2019年8月,获得临床试验默示许可,用于治疗成人慢性丙型肝炎病毒感染。
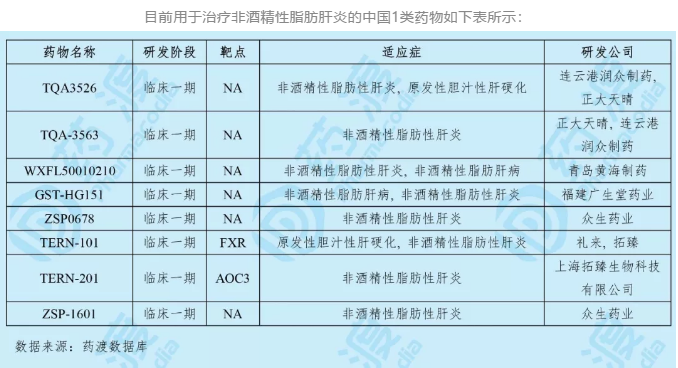
5. TERN-201TERN-201是由上海拓臻生物科技有限公司研发的一种血管粘附蛋白-1抑制剂。2019年5月国家药品监督管理局(NMPA,原CFDA)受理本品的临床试验申请(化药1类)。2019年8月获得临床试验默示许可,用于治疗非酒精性脂肪肝炎。
2019年8月拓瑧生物公布了TERN-201的首次人体临床研究的中期结果。结果表明TERN-201单次口服给药的耐受性良好,没有发现显著的安全性问题或导致停药的不良事件。每个剂量组给药后都可使血浆SSAO活性降低至基线水平以下,并维持长达一周。基于以上结果,该研究已进行到多剂量爬坡阶段。
6. 海曲泊帕乙醇胺
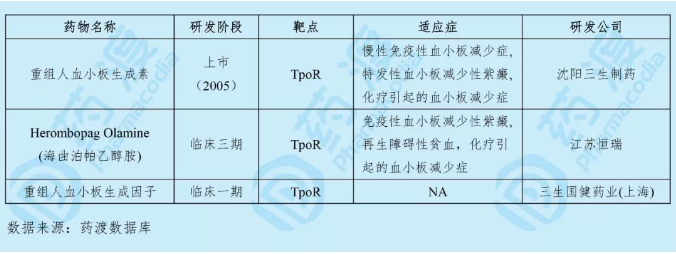
海曲泊帕乙醇胺是由江苏恒瑞医药股份有限公司研发的一种口服吸收的小分子非肽类促血小板生成素受体(TPOR)激动剂。目前处于对糖皮质激素类药物、免疫球蛋白或脾切除疗效欠佳的慢性原发免疫性血小板减少症(ITP)的临床III期研究阶段,而对再生障碍性贫血的研究也进入三期临床。其有望成为艾曲波帕的Me Better品种。2019年8月海曲泊帕乙醇胺获得了NMPA的默示试验许可,用于治疗肿瘤化疗所致的血小板减少症。
研发里程碑2019年2月,海曲泊帕联合标准免疫抑制治疗在初治重型再障患者的安全性和有效性随机、双盲、安慰剂对照III期临床研究(CTR20190158)拟在中国进行。
2018年6月,计划在中国启动一项开放标签、单臂临床I/II期试验(NCT03557099、HR-TPO-SAA-I/II),以在再生障碍性贫血患者中评估其安全性和有效性。
2017年6月,海曲泊帕乙醇胺片在中国原发免疫性血小板减少症患者(n=414)的有效性和安全性多中心、随机、双盲和开放性Ⅲ期临床研究(NCT03222843、CTR20170792、HR-TPO-III-ITP)启动。
2015年5月,由江苏恒瑞在中国提交的II、III期临床补充申请获CDE承办。
2014年3月,在ITP患者(n=24)中评估此药安全性、耐受性、PK、PD性质开放标签、非随机、单臂的临床I期试验(NCT02403440、CTR20140392、SHR-TPOP1d)在中国启动。
2012年4月,在健康志愿者(n=96)中评估此药安全性、耐受性、PK、PD性质的随机、双盲、安慰剂对照的临床I期试验 (NCT02409394、CTR20131861、SHR-TPOP1c) 在中国启动。
2011年5月,由江苏恒瑞医药股份有限公司向CFDA提交的临床试验申请(化药1.1)获CDE承办,且于2012年2月获得临床批件。
6. 海曲泊帕乙醇胺
海曲泊帕乙醇胺是由江苏恒瑞医药股份有限公司研发的一种口服吸收的小分子非肽类促血小板生成素受体(TPOR)激动剂。目前处于对糖皮质激素类药物、免疫球蛋白或脾切除疗效欠佳的慢性原发免疫性血小板减少症(ITP)的临床III期研究阶段,而对再生障碍性贫血的研究也进入三期临床。其有望成为艾曲波帕的Me Better品种。2019年8月海曲泊帕乙醇胺获得了NMPA的默示试验许可,用于治疗肿瘤化疗所致的血小板减少症。
研发里程碑2019年2月,海曲泊帕联合标准免疫抑制治疗在初治重型再障患者的安全性和有效性随机、双盲、安慰剂对照III期临床研究(CTR20190158)拟在中国进行。
2018年6月,计划在中国启动一项开放标签、单臂临床I/II期试验(NCT03557099、HR-TPO-SAA-I/II),以在再生障碍性贫血患者中评估其安全性和有效性。
2017年6月,海曲泊帕乙醇胺片在中国原发免疫性血小板减少症患者(n=414)的有效性和安全性多中心、随机、双盲和开放性Ⅲ期临床研究(NCT03222843、CTR20170792、HR-TPO-III-ITP)启动。
2015年5月,由江苏恒瑞在中国提交的II、III期临床补充申请获CDE承办。
2014年3月,在ITP患者(n=24)中评估此药安全性、耐受性、PK、PD性质开放标签、非随机、单臂的临床I期试验(NCT02403440、CTR20140392、SHR-TPOP1d)在中国启动。
2012年4月,在健康志愿者(n=96)中评估此药安全性、耐受性、PK、PD性质的随机、双盲、安慰剂对照的临床I期试验 (NCT02409394、CTR20131861、SHR-TPOP1c) 在中国启动。
2011年5月,由江苏恒瑞医药股份有限公司向CFDA提交的临床试验申请(化药1.1)获CDE承办,且于2012年2月获得临床批件。
7. HMPL-306
HMPL-306由和记黄埔医药研发的一种异柠檬酸脱氢酶(IDH)1/2抑制剂。2019年6月向国家药品监督管理局(NMPA,原CFDA)递交了临床试验申请(化药1类)。2019年8月获得临床试验默示许可,用于治疗伴有IDH1和/或IDH2突变的血液肿瘤和实体肿瘤。
IDH突变是一些组织癌变的原因之一,在多种肿瘤(包括急性骨髓性白血病(AML)、神经胶质瘤、软骨肉瘤和胆管癌)中,均发现了IDH1和IDH2突变。肿瘤细胞中IDH突变(IDH1m和IDH2m)会导致其正常功能缺失,并将α-KG转化为致癌代谢物2-羟基戊二酸(2HG),2HG在突变的肿瘤细胞中累积,导致DNA或组蛋白过甲基化。IDH抑制剂通过作用于肿瘤细胞中的IDH突变位点,使体内致癌代谢物2HG减少,从而诱导组蛋白去甲基化,达到抑制肿瘤发展的效果。
甲氧依托咪酯盐酸盐由霍尔果斯邀月咨询有限公司、成都力思特制药股份有限公司和四川大学华西医院联合研发,于2019年6月向国家药品监督管理局(NMPA,原CFDA)递交了临床试验申请(化药1类)。2019年8月获得临床试验默示许可,用于诱导和维持全身麻醉的静脉麻醉剂,可以用于重症监护成年患者的镇静,也可用于外科手术及诊断时的镇静。
迪拓赛替是由苏州开拓药业研发的一种新型mTORC1/mTORC2抑制剂,于2019年6月向国家药品监督管理局(NMPA,原CFDA)递交了临床试验申请(化药1类)。2019年8月获得临床试验默示许可,用于治疗晚期实体肿瘤(包括但不限于前列腺癌、乳腺癌、肝癌、卵巢癌、肾癌、肺癌)。
SYHA1801由石药集团中奇制药技术(石家庄)有限公司研发,于2019年6月向国家药品监督管理局(NMPA,原CFDA)递交了临床试验申请(化药1类)。2019年8月获得临床试验默示许可,用于治疗晚期实体瘤,包括但不限于结直肠癌及三阴乳腺癌等。
该产品是一种新型小分子激酶抑制剂,临床前研究显示该产品具有优异的体内体外抗肿瘤活性和良好的安全性,有希望在临床研究中展现出良好的抗癌治疗效果。
ICP-022是诺诚健华医药研发的BTK抑制剂,目前处于临床二期,用于治疗套细胞淋巴瘤(MCL)、慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL),以及复发难治性边缘区淋巴瘤(MZL)、华氏巨球蛋白血症。本品也正在进行治疗类风湿性关节炎(RA)和系统性红斑狼疮(SLE)的一期临床研究。2019年6月诺诚健华向国家药品监督管理局(NMPA,原CFDA)递交了本品的临床试验申请(化药1类),用于联合重组人源化II型CD20单克隆抗体MIL62注射液(临床批件号:2016L09586)治疗复发/难治CD20+B细胞淋巴瘤,并于8月获得了临床试验默示许可。
2019年5月,在美国的IND通过FDA审评。
2019年2月,评价ICP-022治疗复发或难治华氏巨球蛋白血症的临床II期试验(CTR20190364)拟在中国开始。
2019年1月,一项对复发难治边缘区淋巴瘤的II期临床研究计划2019年2月在中国开始。
2018年4月,对复发/难治性CLL或者SLL患者的临床I/II期试验(NCT03493217、CTR20180263、ICP-CL-00103)在中国开始,预计将于2020年12月完成。
2018年2月,一项评价ICP-022治疗复发或难治性套细胞淋巴瘤安全性和有效性的多中心、开放性的临床I/II试验(NCT03494179、ICP-CL-00102、CTR20180196)在中国开始,预计将于2020年12月完成。
2017年7月,一项随机、双盲、安慰剂对照的单中心剂量递增临床I期试验(NCT03189017)在澳大利亚RA和SLE患者中启动,于2017年12月公开消息显示,ICP-022在该研究中显示了良好的安全性和药代药效动力学特性,对治疗类风湿关节炎和系统性红斑狼疮具有良好前景。
2017年6月12日,北京诺诚健华医药科技有限公司首次向中国食品药品监督管理总局(CFDA)提交临床试验申请(化药1类),并于2018年12月19日,获得CFDA批准开展针对系统性红斑狼疮(SLE)和类风湿关节炎(RA)的临床试验。
2018年2月6日,诺诚健华完成5500万美元融资,由维梧资本Vivo Capital领投,原股东上海建信资本等跟投。
盐酸杰克替尼是泽璟制药研发的一种选择性JAK抑制剂,目前处于临床二期,用于治疗骨髓纤维化,包括原发性骨髓纤维化(PMF)、真性红细胞增多症后骨髓纤维化(PPV-MF)或后原发性血小板增多症后骨髓纤维化(PET-MF)。
2019年6月泽璟制药向国家药品监督管理局(NMPA,原CFDA)递交了本品的临床试验申请(化药1类),用于治疗轻中度特应性皮炎和轻中度斑秃,并于8月获得临床试验默示许可。
2018年11月,评估安全性和有效性的治疗骨髓纤维化的临床二期试验在中国开始 (NCT03886415)。
2017年9月,单次和多次口服盐酸杰克替尼片或安慰剂片的随机、双盲、剂量递增的耐受性、药代动力学和食物影响临床I期研究(CTR20170573)在中国开始。
2016年4月,由苏州泽璟生物制药有限公司联合上海泽璟医药技术有限公司向CFDA提交临床试验申请(化药1类),并于2016年12月获得临床试验批件,批件号为:2016L10574(0.1g规格)和2016L10575(50mg规格),获准进入I/II/III期临床研究。
2018年1月15日,泽璟制药完成4亿元人民币的B轮融资。此轮融资由民生保险、深创投和分享投资领投,北极光创投、中青国融等共同参与投资。
2016年8月1日,泽璟制药完成A轮融资,金额未公开,投资方国家中小企业发展基金。
2016年4月1日,泽璟制药完成天使轮融资,金额未公开,投资方盈富泰克。
融资及交易
12. 盐酸杰克替尼
融资及交易
文章来源: 药渡
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。