扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

第一部分 概述
这是一份2012年的技术报告,来自于PDA,适用于生物药品和无菌药品的生产,包括API,药品 (液体和固体)制剂,包装及标签标识管理等,当然这些质量风险管理的思想同样也适用于其他类型的药品生产。
考虑到质量风险管理系列的文章已经在之前2016年7月的分享中就已经写过,大家可以点击下面的链接直接跳转相关的历史文章,所以这次对TR54的分享会侧重于一些对我而言比较“新”或者说让我眼前一亮的关键词。
质量风险管理适用于整个药品商业生产的过程,同时质量风险管理应该和制药行业的质量体系有机结合,ICH Q10中用了一个非常精准的词---Enabler,质量风险管理可以为药品生命周期管理赋能,具体来说,包括以下几点:识别风险|科学评估|控制潜在风险|保证患者安全|持续改进工艺性能和产品质量。
Proactive Approach积极的方法
QRM强调基于对过程的理解,对知识的管理,从而提供了一个系统化的方法,从早期去积极识别风险,采取有效的控制措施去降低风险,而非被动地应对风险。这一概念在后续的一系列数据完整性指南中也得到了提及,我们之前也分享过所谓的数据完整性源于设计以及数据完整性源于设计6个方面的考虑。
Systematic Application系统性应用
强调了质量风险管理应该和质量体系相结合,同时质量风险管理本身也是一个系统化的方法,质量风险管理提供的几个关键的步骤应该在药品的生命周期应用过程中是可复制的,这是西方常用的系统化的思维,PDA的报告中特意强调了风险评估仅是风险管理的一个环节。所以,国内一些企业经常会有的做法,通过风险评估,似乎就可以去Justify为什么不去做一些事情,这个理念也是概念上的错误。
Risk assessment is not synonymous with risk management.PDA TR54
Prioritize优先战略
任何企业以及监管部门的资源都是有限的,所以有效的质量风险管理对于双方都会有大的益处,有效的质量风险管理有助于建立双方的信任,一方面可以降低监管部门对企业的监管水平,另一方面也有助于企业将有限的资源投入到真正高风险的地方。
Effective risk management ensures better understanding of the product and process by identifying gaps in knowledge and can enable a company to prioritize and focus resources appropriately. PDA TR54
Evolutionary渐进的过程
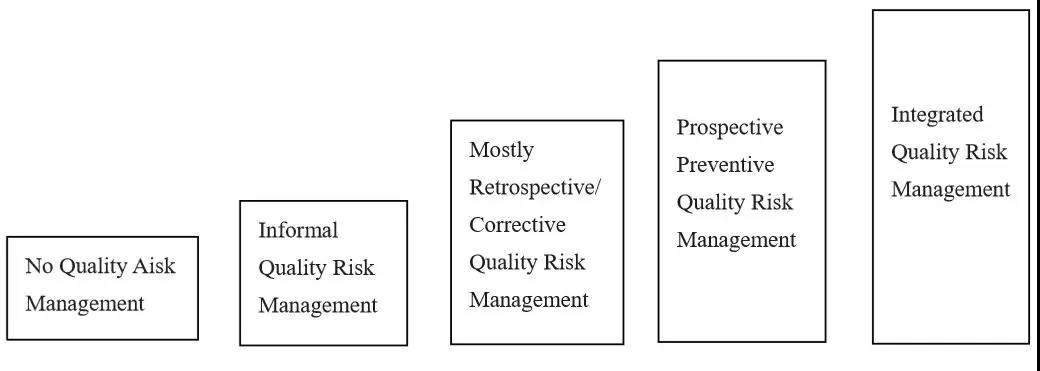
质量风险管理通常会经历以下五个阶段:
没有质量风险管理---非正式的质量风险管理---带有回顾性和纠正性的质量风险管理---带有前瞻性和预防性的质量风险管理---一个有机整体的质量风险管理
第二部分 TR54-质量风险管理方针及高层职责
Policy或者说策略其实是一个很大的词,大到有的时候会对这个词产生怀疑,这个所谓的策略真的有用吗?还是说落实到责任人更重要?
个人认为,从质量体系的角度,一个公司有一个文件去阐述企业如何去执行质量风险管理就足够了,至于这个文件是叫Policy还是叫SOP其实并没有那么重要。
这份策略或者说SOP中应该包括哪些内容,我们来看看TR54的定义:
1. 质量风险管理的适用范围---很多单纯的生产企业,不必要将质量风险管理的范围放得太大,包括GMP中的基本要素要求就行了,前两天文章中提到的开发阶段很多要求并不适用,但是需要重视研发转生产的技术转移和知识传递,质量风险管理很重要的一部分内容就在于Knowledge Transfer;
2. 质量风险管理的问责制和责任制,确定风险的可接受标准---Accountability和Responsibility这两个词的区别不知道大家是否清楚,通俗点儿说Accountability是指最终责任人,通常可以定义为企业的高层,出了事情他从法律上得兜着这事,Responsibility通常是指执行层面的责任人,也就是企业的中层,他对企业的高层负责,如果所有的事情都需要高层亲力亲为,那么这个企业并不成熟,需要去学一学上周六推荐的可复制的领导力课程;
关于管理层的职责,TR54中这样定义:
支持并承诺实施质量风险管理;确保将质量风险管理和质量体系结合,建立相应的流程,提供必要的资源;包括确保参与质量风险管理的人员经过必要的培训;同时,创造一种组织架构和文件氛围,鼓励报告问题,促进不同职能部门间的沟通协调。
3. 质量风险的度量---可以有两种方式定量分析和定性分析,有的人喜欢打分,有的人喜欢分高中低,也可以采取四象限法,无论哪一种方法,每个分数或者说判断的标准都需要明确,这样在执行层面才可以避免走样。
4. 风险的控制---如何去控制风险取决于识别出风险的阶段,从设计上去降低危害发生的可能性以及增加危害的检出度都是可以考虑的操作方式,当然,前面在提到APIC指南的时候也提到,危害的严重性通常是不能被降低的。如果系统最初设计上不能解决,那么可以考虑通过持续的改进去优化,也可能通过流程控制、人员培训等措施去降低危害发生的概率。
5. 风险的回顾和沟通---经典的PDCA戴明环中的Check其实就是所谓的回顾,回顾也是需要整合到质量体系中的,比如说系统需要进行定期再确认,工艺需要进行定期再确认,变更执行完生效后,有必要考虑对变更的有效性进行一个回顾,质量体系也需要定期进行管理评审以确保其有效性等等,回顾过程中的沟通方式也是多样的,沟通只是手段和过程,这里的沟通也包括对内的沟通和对外的沟通,沟通并不是最终的目的,最终的目的还是应该回到质量风险管理的目标上来看。
6. 风险文件的编制---既然说了质量体系需要整合,那么一方面需要将风险识别的输出体现在质量文件中,另一方面也可能会有针对性地形成针对特定主题的质量风险管理报告。
最后,再来说一个QRM指南中常用的词,Facilitator,很难找到一个贴切的翻译,手头的翻译稿中将其翻译成了促进人,促进人一般可以理解为中层的执行者,需要建立和维护质量体系,同时需要有能力执行风险评估,同时具有一定的审批权,有权力做出减少风险至可接受水平的决定。
第三部分 TR54的几个用悖
早期的有预见性的风险管理VS.动态的回顾性的风险管理
理想状态下的风险管理应该是在药品开发早期就要提出,这也是为什么在昨天的TR54-药品生命周期内风险管理的应用的分享中提到ICH Q8产品开发,即使是在商业化生产阶段,风险管理也应该是在新的系统、流程、方法引入之前进行评估。
在产品设计阶段或者新引入设备前做风险评估,有助于将一些风险控制点体现在设备的设计中去降低,从设计上解决问题往往会更加有效和有助于解决问题的本质,远比后期改进流程成本更低。
但是并不是所有的风险都一定可以预见,所以有的时候也有必要采取一些动态的、回顾性的风险管理,风险管理被触发的因素也很多,偏差、变更、审计、定期的管理评审都可以触发对风险管理的回顾。
主动的风险管理VS.被动的风险管理
早期的有预见性的风险管理往往可以认为是一种主动的风险管理方法,但并不能说动态的回顾性的风险管理就一定是被动的风险管理,比如说系统要求定期做回顾,工艺要求定期做再确认,在这个过程中,识别出风险,采取相应的措施并持续改进,某种程度上可以认为是主动的风险管理,被动则往往是由偏差所触发,通过深入的调查,会发现原来的风险认识可能不够充分,这种情况下,采取的风险管理往往就是被动的。
QRM should never be used to deviate from regulations, justify bad practices, defend practices that need to be corrected, or as a substitute for sound science.PDA TR54
同时,PDA的指南中明确提出,质量风险管理不是用于去解释为何违反法规,用于解释|诡辩一些不正确的操作和需要纠正的行为,同时也不是所谓的“听上去”正确的科学理论。
正式的风险管理VS.简易的风险管理
质量风险管理的原则之一是质量风险管理程序的评估结果,其正式性和文档要求应该与其风险级别相适应。
决定风险管理文件正式程度通常会从以下几个方面去考虑:
风险问题的危急程度(例如:影响病人安全或产品质量)
问题、工艺或系统的复杂性
相关历史数据和相关文献的可获得性
工艺知识和经验的实用性程度
PDA提供了两张图:
第一张图体现了从产品开发到商业化生产过程中的风险管理工具的应用和文件越来越正式。
另一张图则从程序,风险小组构成,采用的方法以及文件系统等四个方面,大致描述了一下所谓的正式与非正式。
最后一个问题,希望你能够在留言区分享你的观点,质量风险管理你觉得现在过时了吗?
第四部分 TR54-药品生命周期内风险管理的应用
ICH的Q8|Q9|Q10是一个有机的整体,从产品开发,到质量风险管理,最终一切落实到质量管理体系之中。
风险管理的过程,实际上是一个认知不断提升的过程,包括对物料属性的认知、对生产工艺的认知、对工艺参数的认知,不断提升认知的过程支持着全生命周期的管理。
当然,在产品生命周期的不同阶段,对于风险管理所产生的文件的要求是有所不同的,质量风险管理应用的程度应该与该阶段的可获得的工艺知识和工艺的复杂程度相适应,我们具体来看看典型的产品生命周期。

开发阶段:
药物开发的定义是设计出一个产品及其配套的工艺,以确保其可以持续生产出符合病人和监管机构要求的药品。QRM支持对产品的早期工艺开发以实现如下的几个目标:
产品设计时需要考虑减少对病人的风险以及对产品本身质量的负面影响;
优先进行必要的开发活动,收集产品相关的知识;
建立初步的控制策略,以实现对产品CQA的充分管理;
开发阶段的输出包括:
一个能实现CQA的工艺;
建立合适的给药系统;
识别出影响CQA的关键工艺参数和物料属性;
识别出关键工艺参数,物料属性和过程控制的合理范围;
支持供应商的选择;
技术转移阶段:
技术转移的定义是在药物开发部门与生产部门或在不同的生产岗位中进行知识转移,以实现药物的最终生产。QRM在这一阶段的主要的目标包括:
评估和管理工艺和产品质量风险,以达到技术转移和扩大生产的结果;
帮助知识转移;
在商业化生产过程中驱动控制策略的决策以降低风险;
技术转移阶段达到的目标通常是建立CAPA,以妥善管理确定的风险,并提供及时的过程控制的管理。
商业化生产阶段:
这一阶段的目标在于:用合适的工艺性能实现产品的生产, 建立和维护控制状态,帮助持续改善和扩大知识容量。QRM在这一阶段的目标在于:
主动评估和管理工艺和产品的质量风险;
通过持续改进,建立稳定的控制策略,必要时进行调整,以确保达到预期持续的工艺性能和产品质量;
同时,质量风险管理在变更、偏差、失败调查等决策时也会用到,比如变更和偏差的分级管理,不同级别的偏差调查的要求等,质量风险管理在供应商管理及供应链管理方面,也有相应的应用。
产品退市阶段:
这一阶段的主要目标是有效地管理产品生命周期的最后阶段,确保在市场上销售的产品风险持续可控,确保患者转移到替代疗法时,可以识别和管理相关的风险。
文章来源:制药工程论坛
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。