扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

近日,BioMarin制药公司宣布,其罕见病治疗药物Vimizim(Elosulfase Alfa)获得国家药品监督管理局上市批准,用于治疗黏多糖贮积症IVA型(MPS IVA)患者。值得一提的是,Vimizim是中国首个黏多糖贮积症药物,也是我国第一批《临床急需境外新药名单》里的品种。

MPS IVA是一种罕见的遗传疾病,由于体内降解糖胺聚糖(GAG)的溶酶体酶N-乙酰半乳糖胺-6-硫酸酯酶(GALNS)缺失或活性不足,造成GAG及其代谢物硫酸角质素(KS)和6-硫酸软骨素在多器官和组织内逐渐贮积,进而导致器官功能减退。最常见特征为进展性骨骼发育不良、频繁手术以及活动能力、呼吸功能受限和早期死亡。
目前,MPS IVA在发达国家影响着约3000人。临床上黏多糖贮积症的治疗主要有骨髓移植或造血干细胞移植)、酶替代治疗,但在中国尚无MPS IVA治疗药物或酶替代等治疗方法。根据药品审评中心的公告,BioMarin公司的Vimizim是目前唯一一种适用于MPS IVA患者疾病缓解的药物。
2014年2月,Vimizim在美国获得FDA批准上市。作为内源性N-乙酰半乳糖胺-6-硫酸酯酶的补充,该药能显著改善患者的肌肉强度、关节功能和心肺功能等,改善患者的生存质量。上市5年后,该药已在全球50多个国家治疗超过1300名患者。
2018年5月,中国发布《第一批罕见病目录》,将黏多糖贮积症纳入我国罕见病范畴。同年11月,Vimizim入选我国第一批《临床急需境外新药名单》。这意味着,Vimizim有资格在中国得到优先审评。
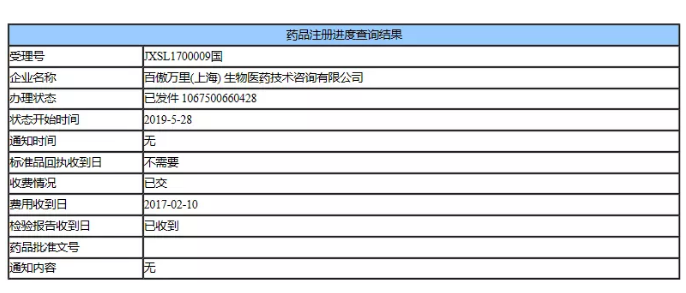
据了解,申请人百傲万里(上海)生物医药公司在2017年首次向国家药品监督管理局递交了Vimizim的临床试验申请(JXSL1700009国),该申请随后被纳入优先审评。今年2月,申请人向药监局递交了该药的补充申请,同时,将药物申请事项变更为上市审评。
▲图片来源:国家药品监督管理局行政事项受理服务
中华医学会儿科学分会副主任委员,儿科学及内分泌遗传代谢学科带头人罗小平教授表示:“Vimizim是首个也是目前唯一能够治疗这种非常罕见的进行性退行性、常染色体隐性溶酶体贮积症的疾病特异性治疗方案。”
目前,Vimizim以中文名依洛硫酸酯酶α注射液(商品名唯铭赞)在中国获得上市批件。该药的获批,也为中国MPS IVA型罕见病患者带来更多治疗选择。
“我们很高兴能够为中国MPS IVA患者提供首个药物疗法,并在此基础上为中国罕见病患者提供服务。”BioMarin董事长兼首席执行官Jean-Jacques Bienaime表示,希望能继续为那些罹患罕见遗传病存在未满足医疗需求的患者提供疗法。
文章来源: 医药观澜
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。