扫一扫 添加小助手
服务热线
13818320332
扫一扫 关注我们

清洁验证概述
在制药企业中,同一设备可能会用于多种产品的生产,在药品生产结束后,对生产用到的相关设备进行有效的清洁,是防止药品污染和交叉污染的必要手段。
在GMP条款中一直强调关于清洁、防止交叉污染的的条款,早在1963年美国颁布GMP条例(133.4)中就写到“生产设备必须保持洁净有序的状态”。为了达到相关法规规范的要求,药品生产企业应保证产品的残留可以通过一定的清洁程序从设备表面清除,并提供书面证据证明各种污染和交叉污染已被有效防止。
设备的清洁程序取决于残留物的性质、设备的结构、材质和清洗的方法,对于确定的设备和产品,清洁效果取决于清洗的方法,书面的、确定的清洁方法即所谓的清洁规程。清洁工艺的运行参数包括清洁剂种类、浓度、接触时间、温度等各种参数。
在制药工业中,清洁的概念是指设备中各种残留物(包括微生物及其代谢产物)的总量低至不影响下批产品的规定的疗效、质量和安全性的状态。通过有效的清洗,可将上批生产残留在生产设备中的物质减少到不会影响下批产品的疗效、质量和安全性的程度。清洁验证即对清洁规程的效力进行确认,通过科学的方法采集足够的证据,以证实按规定的方法清洁后的设备,能始终如一的达到预定的清洁标准。
通常的做法是将清洁验证分为四个阶段,方法开发阶段、方案准备阶段、方案实施阶段、验证状态维护阶段,图1将各个阶段进行流程化,以下分别对其进行阐述。
1开发阶段
根据产品性质、设备特点、生产工艺及所使用的原辅料等因素进行实验室模拟,拟定清洁方法并制定清洁规程,对清洁人员进行操作培训。
2方案准备阶段
首先应该准备清洁验证计划,列出清洁验证的设计与策略,对生产设备进行详细考察,确定有代表性的,难清洁的部位作为取样点;计算设备内表面积,根据产品的相关性质选定某种物质作为参照物质,确定清洁后允许的最大残留量为合格标准,验证中通过检验其含量确定设备清洁的程度,必要时还要考察清洁剂的残留量;根据验证共同要
求制订并批准验证方案,开发验证有关的取样方法和检验方法,以保证数据的准确性,在验证开始前需要对有关人员进行培训。
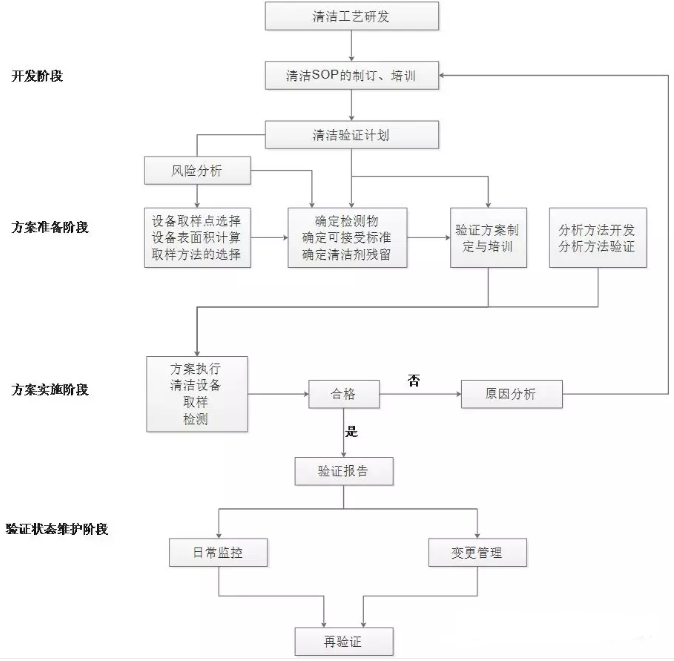
图1 清洁验证四个阶段
3方案实施阶段
按照批准的验证方案开展试验获取数据,评价结果得出结论。如验证的结果表明清洁程序无法确保设备清洁达到预定标准,则需要查找原因、修改程序并重新验证,直至结果合格。
4验证状态维护阶段
已经通过验证的清洁方法随即进行维护阶段,对已投入运行的清洁方法进行监控,对清洁方法的变更实行变更管理,根据监测的结果来看各种生产活动中,所采用的清洁方法能达到的实际效果,以确定再验证的周期进行再验证。
文章来源:马义岭 钟守炜 抗体圈
本网站刊载的所有内容,包括文字、图片、音频、视频、软件等,如非标注为“原创”,则相关版权归原作者所有,如原作者不愿意在本网站刊登相关内容,请及时通知本站,我们将第一时间予以删除。